题目内容
18.FeCl3在水溶液中易水解生成Fe (OH)3和盐酸,有关反应化学方程式:FeCl3+3 H2O═Fe(OH)3+3HCl、加热蒸干并灼烧最终得到Fe2O3.(填化学式)分析 FeCl3在水溶液中易水解生成Fe (OH)3和盐酸,加热促进水解,加热蒸干并灼烧氢氧化铁分解生成氧化铁.
解答 解:FeCl3在水溶液中易水解生成Fe (OH)3和盐酸,水解的反应化学方程式:FeCl3+3 H2O═Fe(OH)3+3HCl;加热促进水解,而且HCl易挥发,所以加热蒸干并灼烧水解生成的氢氧化铁会分解生成氧化铁;
故答案为:FeCl3+3 H2O═Fe(OH)3+3HCl;Fe2O3.
点评 本题考查了水解原理的应用和水解方程式的书写,题目难度不大,注意把握水解原理、以及影响水解平衡移动的因素,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
9.关于食物的酸碱性,下列说法正确的是( )
| A. | 食物溶于水后的溶液pH<7,则称为酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋自质是酸性食物 | |
| C. | 蔬菜、水果是酸性食物 | |
| D. | 柠檬酸是酸性食物 |
3.25℃时,KW=1.0×10-14;100℃时,KW=1.0×10-12,下列说法正确的是( )
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液pH=7 | |
| B. | 25℃时,0.2 mol•L-1 Ba(OH)2溶液和0.2 mol•L-1 HCl等体积混合,所得溶液pH=7 | |
| C. | 25℃时,0.2 mol•L-1 NaOH溶液和0.2 mol•L-1 CH3COOH恰好中和,所得溶液pH=7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液pH>7 |
7.浓硫酸分别和三种钠盐反应,下列分析正确的是( )
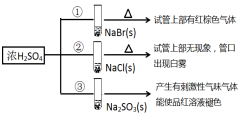

| A. | 对比①和②可以说明还原性Br->Cl- | |
| B. | ①和③相比可说明氧化性Br2>SO2 | |
| C. | ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl | |
| D. | ③中浓H2SO4被还原成SO2 |
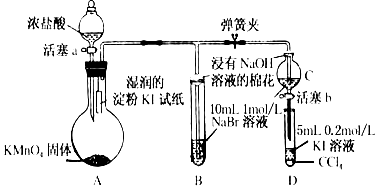
 由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)
由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)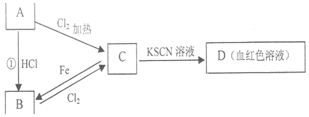 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
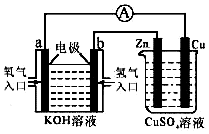
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题: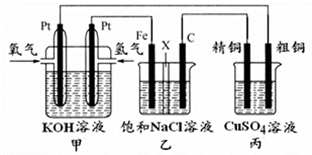 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.