题目内容
10.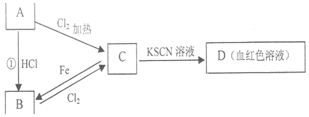 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:(1)物质A是Fe,物质C是FeCl3.
(2)Fe是银白色金属,物质C与Fe反应生成物质B的基本反应类型是化合反应.
(3)物质C的溶液与NaOH溶液混合后产生的现象是红褐色沉淀.
(4)反应①的离子反应方程式Fe+2H+=Fe2++H2↑,其中Fe是还原剂.
分析 A是常见的金属,与氯气反应生成C,C的溶液呈现黄色,且C与KSCN溶液混合溶液为血红色,则C含有Fe3+,由元素守恒可知A为Fe,结合转化关系可知,C为FeCl3,B为FeCl2,以此解答该题.
解答 解:(1)由上述分析可知,A为Fe,C为FeCl3,故答案为:Fe; FeCl3;
(2)铁为银白色金属,与氯化铁反应生成氯化亚铁,为化合反应,故答案为:银白;化合反应;
(3)C为FeCl3,与NaOH溶液反应为FeCl3+3NaOH=Fe(OH)3↓+3NaCl,有红褐色沉淀生成,故答案为:红褐色沉淀;
(4)铁和盐酸反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,反应中铁化合价升高,被氧化,铁为还原剂,故答案为:Fe+2H+=Fe2++H2↑; 还原.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重考查学生的分析能力,C与KSC溶液呈血红色是推断的突破口,明确铁离子的颜色及检验方法是解答本题的关键,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
20.下列各组烃一定是同系物的是( )
| A. | C3H6和 C5H10 | B. | C3H4和 C4H6 | C. | C2H6和 C8H18 | D. | C2H6和 C3H6 |
1.下列叙述不正确的是( )
| A. | 升温水的离子积增大 | |
| B. | pH=7的溶液一定显中性 | |
| C. | NaHSO4 溶液一定显酸性 | |
| D. | 用氢氧化钠溶液滴定硫酸溶液到滴定终点时,混合溶液不一定显中性 |
5.下列关于物质分类错误的是( )
| A. | 盐酸:强电解质 | B. | 氧化铝:两性氧化物 | ||
| C. | 熔融的硫酸钠:电解质 | D. | 次氯酸:氧化性酸 |
15. 短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )
短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )
 短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )
短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )| A. | 原子半径由大到小的顺序:X、Y、Z、W | |
| B. | 元素最高正价由低到高的顺序:Z、X、Y | |
| C. | 单氢化物的热稳定性由弱到强的顺序:Y、W、Z | |
| D. | W的气态氢化物的酸性与Z的最高价氧化物对应水化物的酸性强弱关系:W>Z |
19.下列对各实验装置用途的叙述,不正确的是( )


| A. | 装置①可用于分离C2H5OH和CH3COOCH2CH3的混合物 | |
| B. | 装置②可用于收集H2或Cl2等气体 | |
| C. | 装置③可用于吸收HCl或NH3等气体 | |
| D. | 装置④可用于洗涤BaSO4沉淀 |




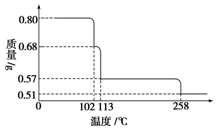 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.