题目内容
6.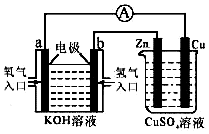 由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)
由化学能转变的热能或电能仍然是人类使用的主要能源,根据如图所示的装置,(其中a、b均为石墨电极)(1)写出以下的电极反应:a 极O2+2H2O+4e-═4OH-b 极H2+2OH--2e-═2H2O
(2)Cu极发生氧化反应,(填“氧化”或“还原”)
(3)当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为2.24L.
(4)CuSO4溶液中H+向Zn极移动
(5)科学家预言,燃料电池将是21世纪获得电力的重要途径,一种氢氧燃料电池是采用铂作为电极,在稀硫酸电解质中直接通入纯化后的氢气,同时向一个电极通入空气,使用该燃料电池的好处是污染少.
分析 左边装置是原电池,氢氧原料原电池中,投放燃料的电极是负极,负极上失电子发生氧化反应,电极反应:H2+2OH--2e-═2H2O,投放氧气的电极是正极,正极上发生还原反应,电极反应:O2+2H2O+4e-═4OH-;右边装置是电解池,与a极正极相连的Cu极为阳极上失电子发生氧化反应,与b极负极相连的Zn极为阴极,得电子发生还原反应,据此分析解答.
解答 解:(1)根据以上分析,a极投放氧气是正极,电极反应:O2+2H2O+4e-═4OH-;b极投放燃料是负极,电极反应:H2+2OH--2e-═2H2O,故答案为:O2+2H2O+4e-═4OH-;H2+2OH--2e-═2H2O;
(2)Cu极与a极正极相连为阳极,发生氧化反应,故答案为:氧化;
(3)根据转移电子数相等,O2------2Cu,当铜片的质量变化了12.8g时,a极上消耗的O2在标准状况下的体积为$\frac{12.8}{64}$×$\frac{1}{2}$×22.4=2.24L,故答案为:2.24;
(4)CuSO4溶液中H+向阴极Zn移动,故答案为:Zn;
(5)燃料电池把化学能转变成电能,对环境影响很小,燃料直接燃烧会对环境造成污染.故答案为:燃料电池的能量化效率高,污染少.
点评 本题考查了原电池和电解池原理,难度不大,注意氢氧燃料电池中电极反应式的书写,书写时要结合电解质溶液的酸碱性,酸碱性不同,电极反应式的书写不同.

练习册系列答案
相关题目
16.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 能与铝反应放出氢气的溶液中:K+、Ca2+、Cl-、HCO3- | |
| C. | pH=2的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
17.以下方法中,不能判断氯元素非金属性比硫强的是( )
| A. | 将氯气通入H2S溶液中,有沉淀产生 | |
| B. | 对比氯气和硫磺在水中的溶解性 | |
| C. | 一定条件下铁分别与硫、氯反应,比较生成物中铁价态 | |
| D. | 比较这两种元素的原子结构 |
14.下列叙述正确的是( )
| A. | 直径介于1~100 nm之间的微粒称为胶体 | |
| B. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 含有最高价态元素的化合物不一定具有很强的氧化性 |
1.下列叙述不正确的是( )
| A. | 升温水的离子积增大 | |
| B. | pH=7的溶液一定显中性 | |
| C. | NaHSO4 溶液一定显酸性 | |
| D. | 用氢氧化钠溶液滴定硫酸溶液到滴定终点时,混合溶液不一定显中性 |
11.下列有关问题,与盐类的水解无关的是( )
| A. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 | |
| B. | 盐酸可作铁制品的除锈剂 | |
| C. | 实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 | |
| D. | 将FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
15. 短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )
短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )
 短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )
短周期元索X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法正确的是为( )| A. | 原子半径由大到小的顺序:X、Y、Z、W | |
| B. | 元素最高正价由低到高的顺序:Z、X、Y | |
| C. | 单氢化物的热稳定性由弱到强的顺序:Y、W、Z | |
| D. | W的气态氢化物的酸性与Z的最高价氧化物对应水化物的酸性强弱关系:W>Z |
16.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | Y、Z两元素的简单离子半径Y>Z | |
| B. | X与W可以形成W2X、W2X2两种化合物 | |
| C. | X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y、Z元素最高价氧化物对应的水化物酸性较强的为H2ZO4 |