题目内容
20.氨气在生产、生活和科研中应用十分广泛.(1)以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159kJ•mol-1
NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72kJ•mol-1
H2O(l)═H2O(g)△H=+44kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-131kJ•mol-1
(2)某温度下,向容积为1000ml的密闭容器中通入4molNH3和2molCO2发生反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如图1所示.
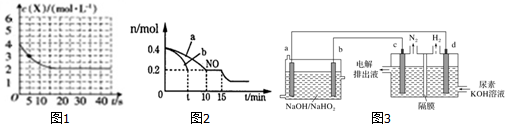
①前5s内,v(H2O)=0.1mol•L-1•s-1.
②该条件下的平衡常数K=0.25.
(3)T℃时,将等物质的量的NO和CO充入体积为2L的密闭容器中,保持温度和体积不变,反应过程(0--15min)中NO的物质的量随时间的变化如图2所示.
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将向右(填“向左”“向右”或“不”) 移动.
②图3中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是b(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是增大CO的物质的量浓度(或增大压强).
(4)已知H2O2是一种弱酸,在强碱溶液中主要以HO${\;}_{2}^{-}$形式存在.现以Al-H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极).
①电解时,Al消耗2.7g,则产生标准状况下氮气的体积为1.12L.
②c电极的电极反应式为CO(NH2)2+8OH--6e-═N2↑+6H2O+CO32-.
分析 (1)由已知热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
(2)①根据图象可知X为氨气,根据v=$\frac{△c}{△t}$计算前5s内v(NH3),然后根据计量数与反应速率成正比计算v(H2O);
②平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)①起始时,NO为4mol,平衡时NO为0.2mol,根据方程式求出平衡时CO、CO2、N2的浓度,根据平衡常数表达式计算;根据Qc与k的相对大小分析;
②催化剂表面积较大,反应速率快,达到平衡所用时间短;
③由图象可知,NO的浓度减小,平衡向正方向移动;
(4)电解时,电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,生成氢气的电极是阴极,则a是负极、b为正极,H2O2-Al燃料电池工作时,Al为负极被氧化,H2O2为正极被还原,以此解答该题.
解答 解:(1)①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72kJ•mol-1
③H2O(l)═H2O(g)△H=+44kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-131kJ/mol,
故答案为:-131;
(2)①X的初始浓度为4mol/L,则X为NH3,5min内v(NH3)=$\frac{4mol/L-3mol/L}{5s}$=0.2mol•L-1•s-1,v(H2O)=$\frac{1}{2}$v(NH3)=0.2mol•L-1•s-1×$\frac{1}{2}$=0.1mol•L-1•s-1,
故答案为:0.1mol•L-1•s-1;
②根据图象可知,平衡时氨气的浓度为2mol/L,
2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),
反应前(mol/L) 4 2 0
转化(mol/L) 2 1 1
平衡时(mol/L) 2 1 1
该稳定性该反应的平衡常数K=$\frac{1}{1×{2}^{2}}$=0.25,
故答案为:0.25;
(3)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2
起始物质的量:0.4mol 0.4mol 0 0
转化的物质量:0.2mol 0.2mol 0.2mol 0.1mol
平衡物质的量:0.2mol 0.2mol 0.2mol 0.1mol
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
该稳定性该反应的平衡常数K=$\frac{0.{1}^{2}×0.05}{0.{1}^{2}×0.{1}^{2}}$=5;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
此时的浓度商Qc=$\frac{0.{1}^{2}×0.45}{0.{1}^{2}×0.{5}^{2}}$=1.8<k,则平衡将向右移动,
故答案为:向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增大CO的物质的量浓度(或增大压强);
(4)①c极生成氮气,说明尿素失去电子被氧化,电极反应式为:CO(NH2)2+8OH--6e-═N2↑+6H2O+CO32-,
故答案为:CO(NH2)2+8OH--6e-═N2↑+6H2O+CO32-;
②每消耗2.7g Al,则转移0.3mol电子,电解池阳极中氮元素化合价由-3价变为0价,在可生成0.05mol氮气,理论上产生气体在标况下体积为:22.4L/mol×0.05mol=1.12L,
故答案为:1.12.
点评 本题考查较为综合,涉及化学平衡的计算、反应热与焓变、化学反应速率的计算及原电池与电解池的应用等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.

| A. | Na2CO3 | B. | Na2O | C. | NaOH | D. | Na2CO3•10H2O |
| A. | 将铁片置于浓硝酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将金属钠置于CuSO4溶液中 | D. | 将铝粉与氧化铁混合发生铝热反应 |
| A. | 该溶液中由水电离出的c(OH-)=10a-14 | |
| B. | 加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$减小 | |
| C. | 该温度下,pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1 | |
| D. | 加入等浓度、等体积的CH3COOH溶液,所得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| A. | Cn(H2O)m | B. | (C2O3)n(H2O)m | C. | (C2H)n(H2O)m | D. | (CO)n(H2O)m |

 (1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.