题目内容
15.25℃时,0.1mol•L-1CH3COONa溶液的pH=a,下列说法错误的是( )| A. | 该溶液中由水电离出的c(OH-)=10a-14 | |
| B. | 加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$减小 | |
| C. | 该温度下,pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1 | |
| D. | 加入等浓度、等体积的CH3COOH溶液,所得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+) |
分析 A.CH3COONa溶液中氢离子和氢氧根离子均由水电离;
B.水解常数只受温度影响;
C.0.1mol•L-1CH3COONa溶液的pH=a,a小于13;
D.根据物料守恒分析.
解答 解:A.CH3COONa溶液中氢离子和氢氧根离子均由水电离,已知溶液的pH=a,则c(H+)=10-a,所以c(OH-)=10a-14,故A正确;
B.0.1mol•L-1CH3COONa溶液中水解常数Kh=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$,水解常数只受温度影响,温度不变,所以水解常数不变,故B错误;
C.0.1mol•L-1CH3COONa溶液的pH=a,a小于13,则c(OH-)小于0.1mol•L-1,所以pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1,故C正确;
D.0.1mol•L-1CH3COONa溶液中加入等浓度、等体积的CH3COOH溶液,CH3COONa和CH3COOH的总浓度 是钠离子浓度的2倍,即c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确.
故选B.
点评 本题考查pH的计算、盐类水解原理,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理、溶液pH的计算方法,试题培养了学生的灵活应用能力.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
10.苯甲酸钠(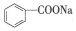 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
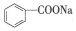 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) |
7.马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图:
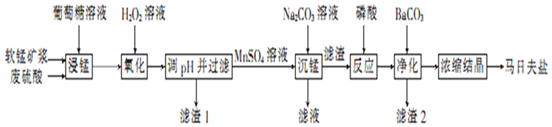
(1)软锰矿要先制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为12:1.
(2)用H2O2溶液“氧化”时发生反应的列子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3(填化学式).
(4)加入磷酸后发生反应的化学方程式为MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O.
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐2.5935t.

(1)软锰矿要先制成矿浆的目的是增大反应物接触面积,加快反应速率,提高原料利用率,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为12:1.
(2)用H2O2溶液“氧化”时发生反应的列子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为5.0~7.8,滤渣1的主要成分为Fe(OH)3和Al(OH)3(填化学式).
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐2.5935t.
4.室温下,H2+Cl2$\stackrel{点燃}{→}$2HCl生成0.1molHCl,下列说法不正确的是( )
| A. | 生成0.1NA根共价键 | B. | 消耗反应物总体积2.24L | ||
| C. | 转移了2NA个电子 | D. | 产物溶于水后,溶液pH=1 |
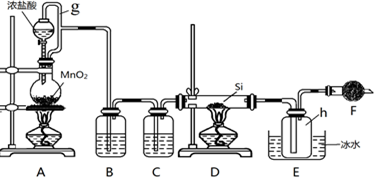
 .
.