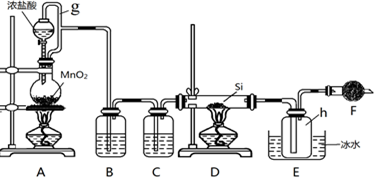
题目内容
11.下列操作能导致置换反应发生的是( )| A. | 将铁片置于浓硝酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将金属钠置于CuSO4溶液中 | D. | 将铝粉与氧化铁混合发生铝热反应 |
分析 置换反应是指由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应.
在金属活动性顺序中,只有排在氢前的金属才可以和稀酸溶液反应生成氢气,只有排在前面的金属可以把排在后面的金属从它的盐溶液中置换出来(钾、钙、钠除外).
解答 解:A.将铁片置于浓硝酸中,硝酸具有强氧化性,不能发生置换反应,故A错误;
B.将锌片置于MgCl2溶液中,根据金属活动性顺序表可知,锌在镁之后,故锌不能将镁置换出,即置换反应不能发生,故B错误;
C.钠是活泼金属,水溶液中钠和水剧烈反应生成氢氧化钠和氢气属于置换反应,氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀是复分解反应,操作能导致置换反应发生,故C正确;
D.将铝粉与氧化铁混合发生铝热反应,生成铁和氧化铝,发生的是置换反应,故D正确;
故选CD.
点评 本题考查了置换反应和复分解反应发生的条件,应注意的是复分解反应发生的条件是能生成沉淀、气体或弱电解质.

练习册系列答案
相关题目
8.下列反应的离子反应方程式正确的是( )
| A. | 过量的二氧化碳通入NaOH溶液中:CO2+OH-═HCO3- | |
| B. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 硫酸亚铁溶液加入过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 向AlCl3溶液中过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
2.亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )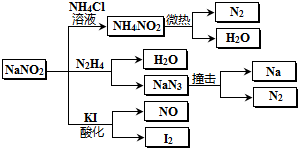

| A. | 分解NaN3盐每产生1molN2 转移6mol e- | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI一淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 |
19.下列物质的转化在给定条件下能实现的是( )
| A. | Al(OH)3$\stackrel{电解}{→}$ Al$→_{高温}^{Fe_{2}O_{3}}$ Fe | |
| B. | S$\stackrel{O_{2}/点燃}{→}$ SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| C. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$ Cu | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$ FeCl3(aq)$\stackrel{△}{→}$ 无水FeCl3 |
16.某元素的原子3d能级上有1个电子,它的N电子层上电子数是( )
| A. | 0 | B. | 10 | C. | 2 | D. | 8 |
1.下列各组物质形成的溶液,不能用FeCl3作为鉴别试剂的是( )
| A. | 食盐、纯碱 | B. | KSCN、碳酸氢钠 | C. | 氨水、AgNO3 | D. | 硫酸钾、硝酸镁 |