题目内容
10.将一小块金属钠长期露置于空气中,最终的产物是( )| A. | Na2CO3 | B. | Na2O | C. | NaOH | D. | Na2CO3•10H2O |
分析 钠和空气反应生成氧化钠,氧化钠再和水反应生成氢氧化钠,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,带结晶水的碳酸钠失水生成碳酸钠.
解答 解:Na的性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3•xH2O,Na2CO3•xH2O风化脱水生成Na2CO3,所以金属钠长期露置于空气中,最终的产物是Na2CO3,
故选A.
点评 本题考查了钠及其化合物的性质,明确钠、氧化钠、氢氧化钠、带结晶水的碳酸钠性质即可解答,注意氢氧化钠易潮解、Na2CO3•xH2O易风化,难度不大.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
7.下列溶液的物质的量浓度不是1mol/L的是( )
| A. | 1L溶液中含1 mol硫酸根离子的H2SO4溶液 | |
| B. | 将500克胆矾溶于2升水中 | |
| C. | 200mL溶液中含32克硫酸铜的溶液 | |
| D. | 把125克胆矾溶于水,配成500mL溶液 |
8.下列反应的离子反应方程式正确的是( )
| A. | 过量的二氧化碳通入NaOH溶液中:CO2+OH-═HCO3- | |
| B. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 硫酸亚铁溶液加入过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 向AlCl3溶液中过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
15.氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
①反应在0~2min内的平均反应速率v(H2)=0.02mol/L.min
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
| 物质 N(mol) 时间(min) | CO2 | H2 | CaO |
| 0 | 0.50 | 1.00 | 0.40 |
| 2 | 0.35 | 0.60 | a |
| 6 | 0.20 | 0.20 | b |
| 8 | 0.20 | 0.20 | b |
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
2.亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )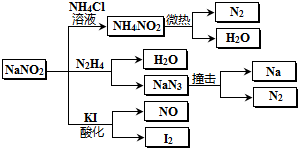

| A. | 分解NaN3盐每产生1molN2 转移6mol e- | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI一淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 |
19.下列物质的转化在给定条件下能实现的是( )
| A. | Al(OH)3$\stackrel{电解}{→}$ Al$→_{高温}^{Fe_{2}O_{3}}$ Fe | |
| B. | S$\stackrel{O_{2}/点燃}{→}$ SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| C. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$ Cu | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$ FeCl3(aq)$\stackrel{△}{→}$ 无水FeCl3 |