题目内容
5.充分燃烧某烃的含氧衍生物,消耗氧气的体积与生成的二氧化碳的体积之比为9:8(相同条件下).则此有机物的最简通式是( )| A. | Cn(H2O)m | B. | (C2O3)n(H2O)m | C. | (C2H)n(H2O)m | D. | (CO)n(H2O)m |
分析 若有机物表示为Cm(H2O)n,则消耗的氧气和生成的二氧化碳的体积比为1:1,实际为9:8,大于1:1,故有机物组成可表示为(CxHy)m(H2O)n,则(x+$\frac{y}{4}$):x=9:8,据此整理出该类化合物的通式;
解答 解若有机物表示为Cm(H2O)n,则消耗的氧气和生成的二氧化碳的体积比为1:1,实际为9:8,大于1:1,故有机物组成可表示为(CxHy)m(H2O)n,则(x+$\frac{y}{4}$):x=9:8,据此整理出该类化合物的通式,整理得x=2y,故该类化合物可以表示为(C2H)n(H2O)m,
故选C.
点评 此题的难度较大,关键是消耗氧气的体积与生成的二氧化碳的体积之比为9:8,确定有机物的分子式为(CxHy)m(H2O)n.

练习册系列答案
相关题目
15.氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
①反应在0~2min内的平均反应速率v(H2)=0.02mol/L.min
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
| 物质 N(mol) 时间(min) | CO2 | H2 | CaO |
| 0 | 0.50 | 1.00 | 0.40 |
| 2 | 0.35 | 0.60 | a |
| 6 | 0.20 | 0.20 | b |
| 8 | 0.20 | 0.20 | b |
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
16.某元素的原子3d能级上有1个电子,它的N电子层上电子数是( )
| A. | 0 | B. | 10 | C. | 2 | D. | 8 |
13.下列关于有机物的叙述正确的是( )
| A. | 治疗疟疾的青蒿素(如图),分子式为C15H20O5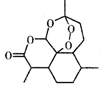 | |
| B. | 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种 | |
| C. | 对三联苯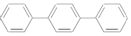 分子中至少有16个原子共平面 分子中至少有16个原子共平面 | |
| D. | 油脂和乙烯在一定条件下都能与水反应,且反应类型相同 |
10.下列离子与氖原子核外电子排布不相同的是( )
| A. | Na+ | B. | F- | C. | Al3+ | D. | S2- |
17.五种短周期主族元素a、b、c、d、e的原子序数依次增大,a和b可组成种类繁多的化合物,c和e同主族,d和e同周期,且d的焰色反应呈黄色.下列说法正确的是( )
| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
14.下列各组物质不能用NaOH鉴别的是( )
| A. | Fe2+和Fe3+ | B. | 酚酞试液和水 | C. | 盐酸和硝酸 | D. | NH4Cl和KCl |