题目内容
9.原子序数小于36的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是( )①XO3-②XO${\;}_{3}^{2-}$ ③XO${\;}_{4}^{2-}$ ④XO${\;}_{4}^{3-}$.
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有① |
分析 原子序数小于36的元素X,其原子最外层中未成对电子数最多,最外层电子数未成对电子数最多为3,则X属于第VA族元素,由此分析解答.
解答 解:原子序数小于36的元素X,其原子最外层中未成对电子数最多,最外层电子数未成对电子数最多为3,则X属于第VA族元素,在形成的阴离子中元素呈现的化合价有+3价、+5价,
①XO3-中X元素显+5价,如硝酸根离子,故①选;
②XO32-中X元素显+4价,但N、P元素不能形成酸根XO32-,故②不选;
③XO42-中的X元素显+6价,故③不选;
④P元素能形成PO43-,故④选;
故选C.
点评 本题考查原子核外电子的排布,题目难度中等,注意根据电子排布式判断未成对电子数.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
19.下列物质的转化在给定条件下能实现的是( )
| A. | Al(OH)3$\stackrel{电解}{→}$ Al$→_{高温}^{Fe_{2}O_{3}}$ Fe | |
| B. | S$\stackrel{O_{2}/点燃}{→}$ SO3$\stackrel{H_{2}O}{→}$ H2SO4 | |
| C. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$ Cu | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$ FeCl3(aq)$\stackrel{△}{→}$ 无水FeCl3 |
17.五种短周期主族元素a、b、c、d、e的原子序数依次增大,a和b可组成种类繁多的化合物,c和e同主族,d和e同周期,且d的焰色反应呈黄色.下列说法正确的是( )
| A. | 简单离子半径:a<c<d<e | |
| B. | 气态氢化物的稳定性e<b<c | |
| C. | 最高价氧化物的水化物酸性b>e | |
| D. | c和d形成的化合物溶于水后溶液呈碱性 |
4.室温下,H2+Cl2$\stackrel{点燃}{→}$2HCl生成0.1molHCl,下列说法不正确的是( )
| A. | 生成0.1NA根共价键 | B. | 消耗反应物总体积2.24L | ||
| C. | 转移了2NA个电子 | D. | 产物溶于水后,溶液pH=1 |
14.下列各组物质不能用NaOH鉴别的是( )
| A. | Fe2+和Fe3+ | B. | 酚酞试液和水 | C. | 盐酸和硝酸 | D. | NH4Cl和KCl |
1.下列各组物质形成的溶液,不能用FeCl3作为鉴别试剂的是( )
| A. | 食盐、纯碱 | B. | KSCN、碳酸氢钠 | C. | 氨水、AgNO3 | D. | 硫酸钾、硝酸镁 |
10.某实验小组配制0.10mol/LNaOH溶液并进行有关性质实验,回答下列问题.
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体2.0g.
(2)从如图中选择称量NaOH固体所需要的仪器是(填字母)abe.
(3)下列情况会使所配溶液浓度偏低的是(填序号)①③⑤⑦
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒.
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体2.0g.
(2)从如图中选择称量NaOH固体所需要的仪器是(填字母)abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  | 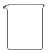 |  |  |  |  |
| 序号 | a | b | c | d | e | f |
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒.
11.有机物T由C、H、O组成,且碳、氢、氧三种元素的质量比为18:3:16,T的相对分子质量小于80.T分子中不可能( )
| A. | 含有2个羧基 | B. | 含有1个甲基 | ||
| C. | 含有2个羟基 | D. | 同时含有1个羟基和1个醛基 |