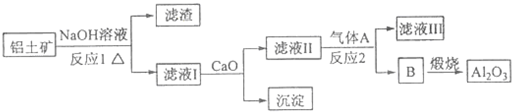
题目内容
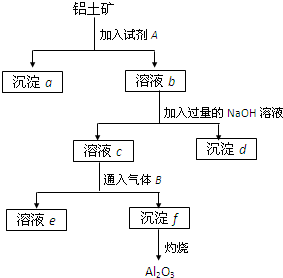 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:(1)沉淀物的化学式分别是:a
(2)溶液b中所含的金属阳离子是
(3)加入的试剂A是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,
(1)根据以上推断写出沉淀的化学式;
(2)铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,滤液c中含有偏铝酸根离子、氯离子和过量的氢氧化钠;
(3)试剂A为盐酸,气体B为二氧化碳,不能够用盐酸代替二氧化碳,根据氢氧化铝能够溶解于盐酸分析.
(1)根据以上推断写出沉淀的化学式;
(2)铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,滤液c中含有偏铝酸根离子、氯离子和过量的氢氧化钠;
(3)试剂A为盐酸,气体B为二氧化碳,不能够用盐酸代替二氧化碳,根据氢氧化铝能够溶解于盐酸分析.
解答:
解:SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能,该工艺流程原理为:铝土矿加入试剂A盐酸,得到滤液b中含有铝离子、铁离子,沉淀a为二氧化硅,b溶液加入过量为氢氧化钠溶液,除去铁离子,沉淀d为氢氧化铁,将铝离子转化为偏铝酸根,进入滤液c中,气体B为二氧化碳,将偏铝酸根转化为氢氧化铝沉淀,加热分解得氧化铝,
(1)根据分析可知,沉淀a为SiO2,沉淀b为Fe(OH)3,沉淀f为Al(OH)3,
故答案为:SiO2;Fe(OH)3;Al(OH)3;
(2)滤液b中含有铁离子和铝离子,根据流程,滤液c中含有过量的氢氧化钠和氯化钠及偏铝酸钠,
故答案为:Al3+、Fe3;AlO2-、Cl-;
(3)气体B为二氧化碳,试剂A为盐酸,氢氧化铝能够与过量的盐酸反应而溶解,无法控制加入盐酸的量,
故答案为:盐酸;CO2;不行,A是强酸,如果过量会使氢氧化铝溶解.
(1)根据分析可知,沉淀a为SiO2,沉淀b为Fe(OH)3,沉淀f为Al(OH)3,
故答案为:SiO2;Fe(OH)3;Al(OH)3;
(2)滤液b中含有铁离子和铝离子,根据流程,滤液c中含有过量的氢氧化钠和氯化钠及偏铝酸钠,
故答案为:Al3+、Fe3;AlO2-、Cl-;
(3)气体B为二氧化碳,试剂A为盐酸,氢氧化铝能够与过量的盐酸反应而溶解,无法控制加入盐酸的量,
故答案为:盐酸;CO2;不行,A是强酸,如果过量会使氢氧化铝溶解.
点评:本题以框图题形式考查铝、硅、铁的化合物的性质、常用化学用语的书写、物质的分离提纯等,难度中等,清楚工艺流程原理是解题的关键,是对知识迁移的综合运用.

练习册系列答案
相关题目
下列化学反应的速率,一定是前者大于后者的( )
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
下列叙述正确的是( )
| A、氯气、SO2都具有氧化性,故而可用于漂白纸浆等 |
| B、常温下浓硫酸能与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| C、H2CO3是弱酸,所以NaHCO3是弱电解质 |
| D、较强的酸可以制取较弱的酸,次氯酸溶液无法制取盐酸 |
当光束通过下列分散系时,能产生丁达尔效应的是( )
| A、硫酸铜溶液 |
| B、氯化铁溶液 |
| C、氢氧化铁胶体 |
| D、氯化钠溶液 |
 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答: