题目内容
标况下,往1mol/L 100mL的石灰水中通入一定量的CO2气体,得到5g沉淀,问:通入CO2的体积是多少时CO2完全反应?
考点:化学方程式的有关计算
专题:
分析:1mol/L 100mL的石灰水中氢氧化钙的物质的量为0.1L×1mol/L=0.1mol,石灰水通入二氧化碳生成5g沉淀为CaCO3,其物质的量为
=0.05mol<0.1mol,可能是氢氧化钙有剩余,根据碳元素守恒n(CO2)=n(CaCO3),可能是氢氧化钙完全反应转化为碳酸钙、碳酸氢钙,根据钙元素守恒计算n[Ca(HCO3)2],根据碳元素是计算n(CO2),再根据V=nVm计算二氧化碳的体积.
| 5g |
| 100g/mol |
解答:
解:1mol/L 100mL的石灰水中氢氧化钙的物质的量为0.1L×1mol/L=0.1mol,石灰水通入二氧化碳生成5g沉淀为CaCO3,其物质的量为
=0.05mol<0.1mol,
当氢氧化钙有剩余时,根据碳元素守恒n(CO2)=n(CaCO3)=0.05mol,故V(CO2)=0.05mol×22.4L/mol=1.12L;
当氢氧化钙完全反应转化为碳酸钙、碳酸氢钙时,根据钙元素守恒n[Ca(HCO3)2]=0.1mol-0.05mol=0.05mol,根据碳元素是n(CO2)=n(CaCO3)+2n[Ca(HCO3)2]=0.05mol+0.05mol×2=0.15mol,故V(CO2)=0.15mol×22.4L/mol=3.36L,
答:通入CO2的体积是1.12L或3.36L时CO2完全反应.
| 5g |
| 100g/mol |
当氢氧化钙有剩余时,根据碳元素守恒n(CO2)=n(CaCO3)=0.05mol,故V(CO2)=0.05mol×22.4L/mol=1.12L;
当氢氧化钙完全反应转化为碳酸钙、碳酸氢钙时,根据钙元素守恒n[Ca(HCO3)2]=0.1mol-0.05mol=0.05mol,根据碳元素是n(CO2)=n(CaCO3)+2n[Ca(HCO3)2]=0.05mol+0.05mol×2=0.15mol,故V(CO2)=0.15mol×22.4L/mol=3.36L,
答:通入CO2的体积是1.12L或3.36L时CO2完全反应.
点评:本题考查化学方程式的有关计算,关键是根据生成的沉淀判断发生的反应,注意利用守恒法计算,难度中等.

练习册系列答案
相关题目
人们在认识事物时经常采用分类的思想方法.下列有关“Na2CO3”的分类中不正确的是( )
| A、电解质 | B、盐 | C、钠盐 | D、碱 |
下列物质都能有Na反应放出H2,其产生的H2的速率排列顺序正确的是( )
①C2H5OH;②CH3COOH;③NaCl(aq)
①C2H5OH;②CH3COOH;③NaCl(aq)
| A、①>②>③ |
| B、②>①>③ |
| C、③>①>② |
| D、②>③>① |
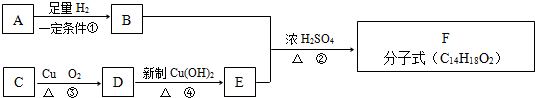
 .已知:
.已知:



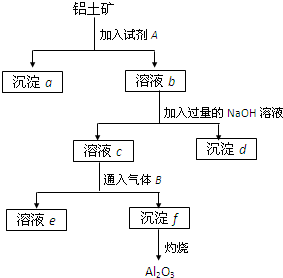 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题: