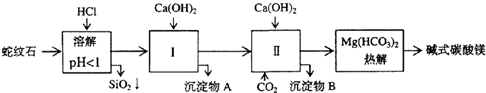
题目内容
铝土矿的主要成分是Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如下:

(1)铝元素在周期表中的位置为 .反应2通入的气体A为 .
(2)写出反应1的化学方程式 ;滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)航母升降机可由铝合金制造.Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为 .焊接过程中使用的保护气为 (填化学式).
(4)航母舰体为合金钢.电解制铝的化学方程式是 ,
(5)航母螺旋桨主要用铜合金制造.80.0g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为 .

(1)铝元素在周期表中的位置为
(2)写出反应1的化学方程式
(3)航母升降机可由铝合金制造.Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为
(4)航母舰体为合金钢.电解制铝的化学方程式是
(5)航母螺旋桨主要用铜合金制造.80.0g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g,则合金中Cu的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝土矿的主要成分是Al2O3和SiO2,向其中加入NaOH得到的是偏铝酸钠和硅酸钠的混合溶液,过滤得到滤液Ⅰ是偏铝酸钠和硅酸钠还有少量剩余的氢氧化钠溶液的混合物和,向其中加入氧化钙,和水反应得到氢氧化钙,硅酸钠和氢氧化钙之间反应生成硅酸钙沉淀和氢氧化钠溶液,滤液Ⅱ的成分是偏铝酸钠和氢氧化钠的混合液,通入过量的气体A二氧化碳,可以得到氢氧化铝沉淀B和碳酸氢钠溶液,即滤液Ⅲ,氢氧化铝沉淀B煅烧得到氧化铝和水,
(1)元素的周期数等于电子层数,族序数等于最外层电子数;
(2)二氧化硅是酸性氧化物,可以和氢氧化铝反应;氧化铝是两性氧化物,可以和氢氧化钠反应;硅酸钠和氢氧化钙之间反应生成硅酸钙沉淀和氢氧化钠溶液;偏铝酸钠可和二氧化碳反应得到氢氧化铝沉淀;
(3)氧化铝是两性氧化物,可以和氢氧化钠反应;
(4)电解氧化铝的熔融物可以得到金属铝和氧气;
(5)根据反应原理结合元素守恒来计算.
(1)元素的周期数等于电子层数,族序数等于最外层电子数;
(2)二氧化硅是酸性氧化物,可以和氢氧化铝反应;氧化铝是两性氧化物,可以和氢氧化钠反应;硅酸钠和氢氧化钙之间反应生成硅酸钙沉淀和氢氧化钠溶液;偏铝酸钠可和二氧化碳反应得到氢氧化铝沉淀;
(3)氧化铝是两性氧化物,可以和氢氧化钠反应;
(4)电解氧化铝的熔融物可以得到金属铝和氧气;
(5)根据反应原理结合元素守恒来计算.
解答:
解:铝土矿的主要成分是Al2O3和SiO2,向其中加入NaOH得到的是偏铝酸钠和硅酸钠的混合溶液,过滤得到滤液Ⅰ是偏铝酸钠和硅酸钠还有少量剩余的氢氧化钠溶液的混合物和,向其中加入氧化钙,和水反应得到氢氧化钙,硅酸钠和氢氧化钙之间反应生成硅酸钙沉淀和氢氧化钠溶液,滤液Ⅱ的成分是偏铝酸钠和氢氧化钠的混合液,通入过量的气体A二氧化碳,可以得到氢氧化铝沉淀B和碳酸氢钠溶液,即滤液Ⅲ,氢氧化铝沉淀B煅烧得到氧化铝和水,
(1)①Al在周期表的位置是:第三周期第ⅢA族,气体A是二氧化碳,可以形成氢氧化铝沉淀,故答案为:第三周期第ⅢA族;CO2;
(2)二氧化硅是酸性氧化物,可以和氢氧化铝反应;氧化铝是两性氧化物,可以和氢氧化钠反应,Al2O3和SiO2中加入NaOH得到的是偏铝酸钠和硅酸钠的混合溶液,发生的反应为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;偏铝酸钠和硅酸钠还有少量剩余的氢氧化钠溶液的混合物和,向其中加入氧化钙,和水反应得到氢氧化钙,硅酸钠和氢氧化钙之间反应生成硅酸钙沉淀和氢氧化钠溶液,滤液Ⅱ的成分是偏铝酸钠和氢氧化钠的混合液,通入过量的气体A二氧化碳,可以得到氢氧化铝沉淀B和碳酸氢钠溶液,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)氧化铝是两性氧化物,可以和氢氧化钠反应,Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,即Al2O3+2NaOH=2NaAlO2+H2O;焊接过程中使用的保护气是一种性质稳定的气体,可以用氩气,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Ar;
(4)电解氧化铝的熔融物可以得到金属铝和氧气,即2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑;
(5)80.0g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g为氢氧化铝,根据Al元素守恒,Al~Al(OH)3,产生沉淀的物质的量是0.5mol,所以含有金属铝的物质的量是0.5mol,金属铝的质量m=0.5mol×27g/mol=13.5g,合金中Cu的质量分数为
×100%=83.1%.
故答案为:83.1%.
(1)①Al在周期表的位置是:第三周期第ⅢA族,气体A是二氧化碳,可以形成氢氧化铝沉淀,故答案为:第三周期第ⅢA族;CO2;
(2)二氧化硅是酸性氧化物,可以和氢氧化铝反应;氧化铝是两性氧化物,可以和氢氧化钠反应,Al2O3和SiO2中加入NaOH得到的是偏铝酸钠和硅酸钠的混合溶液,发生的反应为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;偏铝酸钠和硅酸钠还有少量剩余的氢氧化钠溶液的混合物和,向其中加入氧化钙,和水反应得到氢氧化钙,硅酸钠和氢氧化钙之间反应生成硅酸钙沉淀和氢氧化钠溶液,滤液Ⅱ的成分是偏铝酸钠和氢氧化钠的混合液,通入过量的气体A二氧化碳,可以得到氢氧化铝沉淀B和碳酸氢钠溶液,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;CaSiO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)氧化铝是两性氧化物,可以和氢氧化钠反应,Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,即Al2O3+2NaOH=2NaAlO2+H2O;焊接过程中使用的保护气是一种性质稳定的气体,可以用氩气,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;Ar;
(4)电解氧化铝的熔融物可以得到金属铝和氧气,即2Al2O3(熔融)
| ||
| ||
(5)80.0g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0g为氢氧化铝,根据Al元素守恒,Al~Al(OH)3,产生沉淀的物质的量是0.5mol,所以含有金属铝的物质的量是0.5mol,金属铝的质量m=0.5mol×27g/mol=13.5g,合金中Cu的质量分数为
| 80g-13.5g |
| 80g |
故答案为:83.1%.
点评:本题考查化学工艺流程、无机物推断、电解原理等,题目难度中等,理解工艺流程是解题的关键,需要学生基本扎实的据此与运用知识分析解决问题的能力.

练习册系列答案
相关题目
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断合理的是( )


| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |
下列各组物质,属于电解质是( )
| A、NaCl晶体 | B、铜 |
| C、酒精 | D、硫酸溶液 |
现有A.B.C三种化合物,各取20g相混合,完全反应后,得9g B,24.5g C,还有D生成.已知D的相对分子质量为106.现将11gA和5.5gB反应,能生成D( )
| A、1mol |
| B、0.5mol |
| C、0.125mol |
| D、0.25mol |
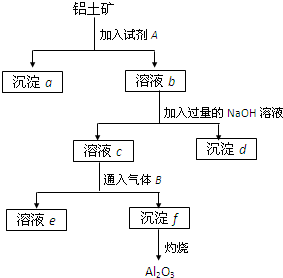 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题: