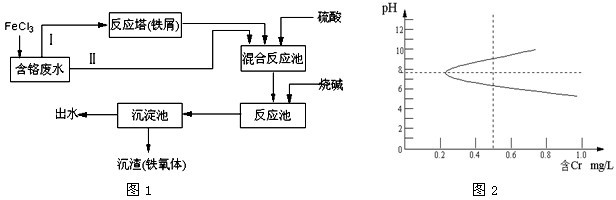
题目内容
下列叙述正确的是( )
| A、氯气、SO2都具有氧化性,故而可用于漂白纸浆等 |
| B、常温下浓硫酸能与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| C、H2CO3是弱酸,所以NaHCO3是弱电解质 |
| D、较强的酸可以制取较弱的酸,次氯酸溶液无法制取盐酸 |
考点:氯气的化学性质,氯、溴、碘及其化合物的综合应用,二氧化硫的化学性质,浓硫酸的性质
专题:元素及其化合物
分析:A.二氧化硫的漂白不具有氧化性;
B.常温下铝与浓硫酸发生钝化,可在表面生成一层致密的氧化膜;
C.NaHCO3为盐类物质,为强电解质;
D.次氯酸可分解生成盐酸.
B.常温下铝与浓硫酸发生钝化,可在表面生成一层致密的氧化膜;
C.NaHCO3为盐类物质,为强电解质;
D.次氯酸可分解生成盐酸.
解答:
解:A.二氧化硫具有强还原性,可与有色有机物发生化合反应而漂白,不体现氧化性,故A错误;
B.常温下铝与浓硫酸发生钝化,可在表面生成一层致密的氧化膜,可阻碍反应的继续进行,故B正确;
C.NaHCO3为盐类物质,为强电解质,故C错误;
D.次氯酸不稳定,光照条件下可分解生成盐酸,故D错误.
故选B.
B.常温下铝与浓硫酸发生钝化,可在表面生成一层致密的氧化膜,可阻碍反应的继续进行,故B正确;
C.NaHCO3为盐类物质,为强电解质,故C错误;
D.次氯酸不稳定,光照条件下可分解生成盐酸,故D错误.
故选B.
点评:本题考查较为综合,涉及二氧化硫、铝、碳酸氢钠以及次氯酸的性质,为高频考点和常见题型,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
下列物质都能有Na反应放出H2,其产生的H2的速率排列顺序正确的是( )
①C2H5OH;②CH3COOH;③NaCl(aq)
①C2H5OH;②CH3COOH;③NaCl(aq)
| A、①>②>③ |
| B、②>①>③ |
| C、③>①>② |
| D、②>③>① |
下列有关说法正确的是( )
| A、在同温同压下,相同体积的任何气体含有相同数目的原子 |
| B、氧化还原反应的判断依据是元素化合价是否有变化 |
| C、能导电的物质一定是电解质 |
| D、金属氧化物不一定是碱性氧化物 |
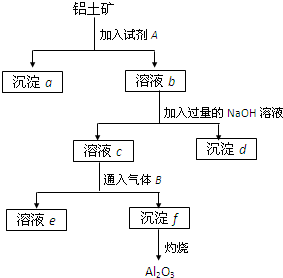 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题: