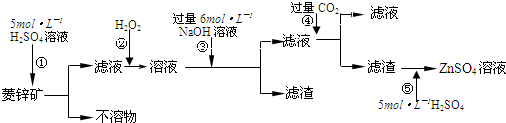
题目内容
下列化学反应的速率,一定是前者大于后者的( )
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:影响化学反应速率的主要因素为物质的本身性质,为内因,对于同一个化学反应来说,增大浓度、压强,升高温度或加入催化剂、增大固体表面积等,可增大反应速率,以此解答该题.
解答:
解:A.反应不同,不能确定反应速率大小,故A错误;
B.锌比铁活泼,则锌反应较快,故B正确;
C.放在食盐水发生电化学腐蚀,反应速率较大,故C错误;
D.氢离子浓度相同,反应速率相等,故D错误.
故选B.
B.锌比铁活泼,则锌反应较快,故B正确;
C.放在食盐水发生电化学腐蚀,反应速率较大,故C错误;
D.氢离子浓度相同,反应速率相等,故D错误.
故选B.
点评:本题考查化学反应速率,为高频考点,侧重于学生的分析能力的考查,注意把握影响化学反应速率的因素,易错点为A,难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
在25℃时,某溶液中由水电离出的c(H+)=1.0×10-12mol/L,则该溶液中可能大量共存的离子是( )
| A、Na+、OH-、S2-、NO3- |
| B、AlO2-、K+、Fe3+、Na+ |
| C、Al3+、Cl-、HCO3-、Na+ |
| D、Fe2+、K+、Cl-、NO3- |
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断合理的是( )


| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |

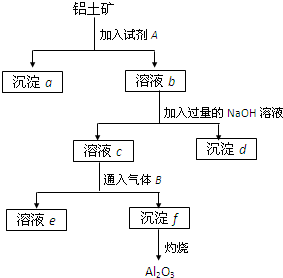 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题: