题目内容
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝,流程如下,回答下列问题:

(1)画出Al的原子结构示意图 .
(2)写出反应①中的化学方程式: , .
(3)写出反应②中的离子方程式: , .
(4)写出滤液B中溶质的化学式 .
(5)甲同学在实验室中用如左下图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.乙同学分析认为:甲同学通入的CO2中含有HCl气体,是导致实验失败的原因.乙同学认为在实验装置Ⅰ和装置Ⅱ之间增加右下图装置可解决这个问题.请在右下图装置的横线上注明试剂名称.

(6)工业上通常以铝土矿提取得到的Al2O3为原料制备无水氯化铝:2Al2O3+6Cl2+3C
4AlCl3+3CO2
该反应中的还原剂是 ,若制得22.4L(标准状况下)CO2气体时,则有 mol电子发生转移.

(1)画出Al的原子结构示意图
(2)写出反应①中的化学方程式:
(3)写出反应②中的离子方程式:
(4)写出滤液B中溶质的化学式
(5)甲同学在实验室中用如左下图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象.乙同学分析认为:甲同学通入的CO2中含有HCl气体,是导致实验失败的原因.乙同学认为在实验装置Ⅰ和装置Ⅱ之间增加右下图装置可解决这个问题.请在右下图装置的横线上注明试剂名称.

(6)工业上通常以铝土矿提取得到的Al2O3为原料制备无水氯化铝:2Al2O3+6Cl2+3C
| ||
该反应中的还原剂是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)根据原子结构示意图的画法来解答;
(2)氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅;
(3)②为过量的氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根
(4)②为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液;
(5)在实验装置Ⅰ和装置Ⅱ之间增加除去CO2中含有HCl气体的装置,根据NaHCO3溶液能与HCl气体反应,而不与二氧化碳反应分析;
(6)Cl2有强氧化性,还原剂是有元素化合价降低的物质,根据碳元素化合价变化计算转移电子数目.
(2)氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸.①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅;
(3)②为过量的氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根
(4)②为氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液;
(5)在实验装置Ⅰ和装置Ⅱ之间增加除去CO2中含有HCl气体的装置,根据NaHCO3溶液能与HCl气体反应,而不与二氧化碳反应分析;
(6)Cl2有强氧化性,还原剂是有元素化合价降低的物质,根据碳元素化合价变化计算转移电子数目.
解答:
解:(1)Al元素是第13号元素,核内由13个质子,核外有13个电子,Al元素的原子的最外层电子数是3,可以作出Al元素的原子结构示意图 ,
,
故答案为: ;
;
(2)①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.①氧化铝与盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl═2AlCl3+3H2O,氧化铁与盐酸反应生成氯化铁与水,反应方程式为 Fe2O3+6HCl═2Fe2Cl3+3H2O.
故答案为:Al2O3+6HCl═2AlCl3+3H2O;Fe2O3+6HCl═2Fe2Cl3+3H2O;
(3)②为过量的氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓;
故答案为:Al3++4OH-=AlO2-+2H2O;Fe3++3OH-=Fe(OH)3↓;
(4)①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅,②为过量的氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液,所以滤液B中溶质的化学式为:NaAlO2、NaCl、NaOH,
故答案为:NaAlO2、NaCl、NaOH;
(5)在实验装置Ⅰ和装置Ⅱ之间增加除去CO2中含有HCl气体的装置,NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,在除去氯化氢的同时增加了二氧化碳的量,故答案为:饱和碳酸氢钠溶液;
(6)2Al2O3+6Cl2+3C
4AlCl3+3CO2↑反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,碳从0价变为+4价,是还原剂,若制得22.4L(标况下)CO2气体时,即1mol二氧化碳,转移电子为1mol×4=4mol,故答案为:C;4.
 ,
,故答案为:
 ;
;(2)①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅.①氧化铝与盐酸反应生成氯化铝和水,反应方程式为Al2O3+6HCl═2AlCl3+3H2O,氧化铁与盐酸反应生成氯化铁与水,反应方程式为 Fe2O3+6HCl═2Fe2Cl3+3H2O.
故答案为:Al2O3+6HCl═2AlCl3+3H2O;Fe2O3+6HCl═2Fe2Cl3+3H2O;
(3)②为过量的氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓;
故答案为:Al3++4OH-=AlO2-+2H2O;Fe3++3OH-=Fe(OH)3↓;
(4)①为盐酸,则在①得到滤液中含有铝离子、铁离子,滤渣为二氧化硅,②为过量的氢氧化钠溶液,除去铁离子,将铝离子转化为偏铝酸根,进入②得到滤液,所以滤液B中溶质的化学式为:NaAlO2、NaCl、NaOH,
故答案为:NaAlO2、NaCl、NaOH;
(5)在实验装置Ⅰ和装置Ⅱ之间增加除去CO2中含有HCl气体的装置,NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,在除去氯化氢的同时增加了二氧化碳的量,故答案为:饱和碳酸氢钠溶液;
(6)2Al2O3+6Cl2+3C
| ||
点评:本题考查用铝土矿提取氧化铝,理解工艺流程是解题的关键,平时注意分析问题、解决问题的能力的培养,题目难度中等.

练习册系列答案
相关题目
人们在认识事物时经常采用分类的思想方法.下列有关“Na2CO3”的分类中不正确的是( )
| A、电解质 | B、盐 | C、钠盐 | D、碱 |
下列有关说法正确的是( )
| A、在同温同压下,相同体积的任何气体含有相同数目的原子 |
| B、氧化还原反应的判断依据是元素化合价是否有变化 |
| C、能导电的物质一定是电解质 |
| D、金属氧化物不一定是碱性氧化物 |
现有A.B.C三种化合物,各取20g相混合,完全反应后,得9g B,24.5g C,还有D生成.已知D的相对分子质量为106.现将11gA和5.5gB反应,能生成D( )
| A、1mol |
| B、0.5mol |
| C、0.125mol |
| D、0.25mol |

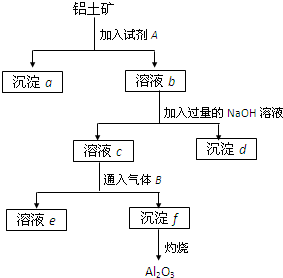 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题: