题目内容
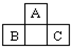 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:(1)写出基态C原子的核外电子排布式:
(2)短周期元素D与A同主族,则A、B、D三种元素氢化物的稳定性由强到弱的顺序为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,A处于第二周期,B、C处于第三周期,A、C两元素原子核外分别有两个、一个未成对电子,且为相邻的族,最外层电子数相差1,故A、C原子的p能级各轨道都应填充电子,则A核外电子排布为1s22s22p4,C的核外电子排布为1s22s22p63s23p5,故A为氧元素,C为Cl元素,B为P元素,据此解答.
解答:
解:依据分析可知:A为氧,B为磷,C为氯,
(1)C为Cl,Cl有3个电子层,最外层电子数为7,故其核外电子排布式为:[Ne]3s23p5,故答案为:[Ne]3s23p5;
(2)短周期元素D与O同主族,那么D为S,则O、P、S三种元素氢化物分别为:H2O、PH3、H2S,由于非金属性P<S<O,故氢化物的稳定性由强到弱的顺序为H2O>H2S>PH3,PH3类似与氨气,故为三角锥形,其中P采取sp3杂化,故答案为:H2O>H2S>PH3;三角锥形;sp3.
(1)C为Cl,Cl有3个电子层,最外层电子数为7,故其核外电子排布式为:[Ne]3s23p5,故答案为:[Ne]3s23p5;
(2)短周期元素D与O同主族,那么D为S,则O、P、S三种元素氢化物分别为:H2O、PH3、H2S,由于非金属性P<S<O,故氢化物的稳定性由强到弱的顺序为H2O>H2S>PH3,PH3类似与氨气,故为三角锥形,其中P采取sp3杂化,故答案为:H2O>H2S>PH3;三角锥形;sp3.
点评:本题考查结构物质关系、核外电子排布规律、杂化理论与分子构型、元素周期律等,题目难度不大,注意根据结构推断元素.

练习册系列答案
相关题目
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断合理的是( )


| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |
现有A.B.C三种化合物,各取20g相混合,完全反应后,得9g B,24.5g C,还有D生成.已知D的相对分子质量为106.现将11gA和5.5gB反应,能生成D( )
| A、1mol |
| B、0.5mol |
| C、0.125mol |
| D、0.25mol |
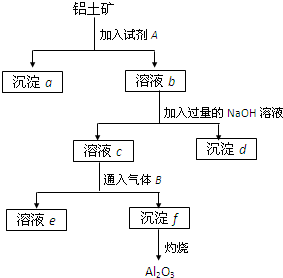 铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题:
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3.回答下列问题: