题目内容
10.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示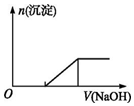 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
分析 A.Fe2+可被ClO- 氧化而不能大量共存;
B.若Fe2+被氧化为Fe3+,只需滴入几滴KSCN溶液即可鉴别;
C.滴加NaOH溶液,首先Fe2+先与OH-反应生成白色沉淀;
D.漏掉了NH4+与OH-的反应.
解答 解:A.(NH4)2Fe(SO4)2中含有Fe2+,Fe2+可被ClO- 氧化而不能大量共存,故A错误;
B.滴入几滴KSCN溶液,若溶液变红色,说明Fe2+被氧化为Fe3+,故B正确;
C.滴加NaOH溶液,首先Fe2+先与OH-反应生成白色沉淀,图象错误,故C错误;
D.恰好使SO42-完全沉淀的离子方程式为:2NH4++Fe2++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)2↓+2NH3↑+2H2O,故D错误;
故选B.
点评 本题考查了水溶液中的离子反应,涉及离子大量共存、离子反应先后顺序、Fe3+的检验、离子方程式的书写,综合性较强,难度中等,注意书写离子方程式时不能漏掉部分离子反应.

练习册系列答案
相关题目
20.I.在容积为2L的密闭容器中,充入1.80molHI气体,某温度时发生反应:2HI(g)?H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
(1)用H2表示0~2min内该反应的平均速率v(H2)=0.02mol•L-1•min-1.
(2)不能说明该反应达到化学平衡状态的是BC.
A.正、逆反应速率相等
B.c(HI):c(H2):c(I2)=2:1:1
C.反应容器内气体的总物质的量不随时间变化
II.回答下列问题:
(3)葡萄糖在酒化酶的作用下可以得到乙醇.乙醇与乙酸反应生成有香味的产物,该反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型为取代反应(或酯化反应).
(4)检验葡萄糖常用新制Cu(OH)2悬浊液,将二者混合共热,观察到现象生成砖红色沉淀(或红色沉淀).
(5)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯的结构简式为 .
.
(6)下列有关苯的叙述正确的是AB(填序号).
A.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
B.苯分子里的6个碳原子和6个氢原子在同一个平面上
C.苯滴入溴水中,振荡后水层接近无色,是因为发生了加成反应.
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
(2)不能说明该反应达到化学平衡状态的是BC.
A.正、逆反应速率相等
B.c(HI):c(H2):c(I2)=2:1:1
C.反应容器内气体的总物质的量不随时间变化
II.回答下列问题:
(3)葡萄糖在酒化酶的作用下可以得到乙醇.乙醇与乙酸反应生成有香味的产物,该反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型为取代反应(或酯化反应).
(4)检验葡萄糖常用新制Cu(OH)2悬浊液,将二者混合共热,观察到现象生成砖红色沉淀(或红色沉淀).
(5)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯的结构简式为
 .
.(6)下列有关苯的叙述正确的是AB(填序号).
A.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
B.苯分子里的6个碳原子和6个氢原子在同一个平面上
C.苯滴入溴水中,振荡后水层接近无色,是因为发生了加成反应.
1.下列事实与胶体的性质有关的是( )
①用盐卤点豆腐 ②微波手术能大大减少病人出血量
③用明矾净水 ④江河入海口形成三角洲.
①用盐卤点豆腐 ②微波手术能大大减少病人出血量
③用明矾净水 ④江河入海口形成三角洲.
| A. | 只有①② | B. | 只有①②④有尽有 | C. | 只有①②③ | D. | 全部 |
19.下列实验方法能达到实验目的是( )
| A. | 用分液漏斗将酒精和水分离 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH 溶液除去Cl2中混有的少量HCl | |
| D. | 用灼烧并闻气味,确定纤维是否是蛋白质纤维 |
20.在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H12H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
2H2S(g)+O2(g)═2 S(g)+2H2O(g)△H32S(g)═S2(g)△H4
则△H4的正确表达式为( )
H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H12H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
2H2S(g)+O2(g)═2 S(g)+2H2O(g)△H32S(g)═S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=$\frac{2}{3}$ (3△H3-△H1)-△H2 | B. | △H4=$\frac{2}{3}$ (△H1+△H2)+△H3 | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2)-△H3 | D. | △H4=$\frac{2}{3}$ (△H1-△H2)-△H3 |
 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
