题目内容
2.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图1(已知2KI+Cl2═2KCl+I2,碘与溴一样易溶于有机溶剂):
(1)指出提取碘的过程中有关的实验操作名称:①过滤,③萃取.
(2)提取碘的过程中,可供选择的有机试剂是AB.
A.苯 B.四氯化碳 C.酒精
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是分液漏斗.
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图2所示实验装置中的错误之处:
①加热时没有垫石棉网.
②温度计位置错误.
③冷凝水进出口方向错误.
(5)进行上述蒸馏操作时使用水浴的原因是受热均匀,温度较低容易控制.
(6)四氯化碳是无色液体.如果本实验用苯做萃取剂,则上层液体的颜色为紫红色或紫色色,下层液体中溶质的主要成分为KCl(写化学式).
分析 (1)分离固体与液体混合物应用过滤;依据碘单质易溶于有机溶剂,结合萃取分液操作解答;
(2)选用的萃取剂的原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂;
(3)依据分液操作用到的仪器解答;
(4)蒸馏实验中蒸馏烧瓶加热应垫石棉网;温度计测定温度为蒸汽的温度;为达到最佳冷凝效果冷凝水与蒸汽流向相反,据此解答;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点;
(6)四氯化碳是无色液体;苯密度比水小,在上层,下层为KCl溶液.
解答 解:(1)分离固体和液体用过滤,③将碘水中的碘单质萃取出来,选择合适的萃取剂即可,故答案为:过滤; 萃取;
(2)提取碘的过程中为萃取,萃取剂选择原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,
A.苯与水互不相溶,碘在苯中溶解度远远大于水中,故A选;
B.四氯化碳与水互不相溶,碘在四氯化碳中溶解度远远大于水中,故B选;
C.酒精与水互溶,不能萃取碘水中的碘,故C不选;
故选:AB;
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,应进行萃取分液操作,分液操作用到的仪器:分液漏斗、玻璃棒、烧杯、铁架台(带铁夹),所以还缺少的主要仪器为分液漏斗;
故答案为:分液漏斗;
(4)烧杯受热要垫石棉网,增大受热面积;冷凝水应是下进上出,冷凝水的方向错误,应为下进上出;温度计水银球的位置错误,温度计水银球应与烧瓶支管口相平;
故答案为:加热时没有垫石棉网;温度计位置错误;冷凝水进出口方向错误;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,
故答案为:受热均匀,温度较低容易控制;
(6)四氯化碳是无色液体;已知2KI+Cl2═2KCl+I2,故碘单质被萃取后水溶液里主要是KCl溶液,苯的密度比水的小,故苯萃取碘后在上层,呈紫红色,KCl在下层,无色,
故答案为:无;紫红色或紫色; KCl.
点评 本题考查海水资源的综合利用,为高频考点,主要是海水提碘,侧重考查物质的检验、混合物的分离和提纯,明确常见混合物分离和提纯方法及其选取方法是解本题关键,题目难度中等.

 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示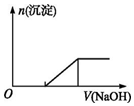 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“>”、“<”或“=”).
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)计算容器②中反应的平衡常数K=1.
如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=2.041(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)?2H2O(g)△H=-241.8KJ/mol,平衡后压缩容器体积至原来的$\frac{1}{2}$,其他条件不变,对平衡体系产生的影响是c (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.
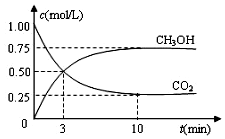 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.