题目内容
20.I.在容积为2L的密闭容器中,充入1.80molHI气体,某温度时发生反应:2HI(g)?H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
(2)不能说明该反应达到化学平衡状态的是BC.
A.正、逆反应速率相等
B.c(HI):c(H2):c(I2)=2:1:1
C.反应容器内气体的总物质的量不随时间变化
II.回答下列问题:
(3)葡萄糖在酒化酶的作用下可以得到乙醇.乙醇与乙酸反应生成有香味的产物,该反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型为取代反应(或酯化反应).
(4)检验葡萄糖常用新制Cu(OH)2悬浊液,将二者混合共热,观察到现象生成砖红色沉淀(或红色沉淀).
(5)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯的结构简式为
 .
.(6)下列有关苯的叙述正确的是AB(填序号).
A.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
B.苯分子里的6个碳原子和6个氢原子在同一个平面上
C.苯滴入溴水中,振荡后水层接近无色,是因为发生了加成反应.
分析 I.(1)由表格中数据可知,0~2min内HI减少1.80mol-1.64mol=0.16mol,由2HI(g)?H2(g)+I2(g),可知生成氢气为0.08mol,结合v=$\frac{△c}{△t}$计算;
(2)结合平衡的特征”等、定“及衍生的物理量判定平衡;
II.(3)乙醇与乙酸反应生成乙酸乙酯和水,为酯化反应,属于取代反应;
(4)葡萄糖含-CHO,能被新制Cu(OH)2悬浊液氧化;
(5)乙烯通入溴的四氯化碳溶液中,发生加成反应生成1,2-二溴乙烷;乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯中不含双键;
(6)苯为平面结构,不含双键,不能与溴水发生加成反应.
解答 解:I.(1)由表格中数据可知,0~2min内HI减少1.80mol-1.64mol=0.16mol,由2HI(g)?H2(g)+I2(g),可知生成氢气为0.08mol,则用H2表示0~2min内该反应的平均速率v(H2)=$\frac{\frac{0.08mol}{2L}}{2min}$=0.02mol•L-1•min-1,故答案为:0.02mol•L-1•min-1;
(2)A.正、逆反应速率相等,达到平衡状态,故A不选;
B.c(HI):c(H2):c(I2)=2:1:1,与起始量、转化率有关,不能判定平衡状态,故B选;
C.该反应为反应前后气体物质的量不变的反应,则反应容器内气体的总物质的量始终不随时间变化,不能判定平衡状态,故C选;
故答案为:BC;
II.(3)乙醇与乙酸反应生成乙酸乙酯和水,为酯化反应,属于取代反应,反应为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;取代反应(或酯化反应);
(4)葡萄糖含-CHO,能被新制Cu(OH)2悬浊液氧化,则检验葡萄糖常用新制Cu(OH)2悬浊液,将二者混合共热,观察到现象为生成砖红色沉淀(或红色沉淀),
故答案为:生成砖红色沉淀(或红色沉淀);
(5)乙烯通入溴的四氯化碳溶液中,发生加成反应生成1,2-二溴乙烷,反应为CH2=CH2+Br2→CH2BrCH2Br;乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯中不含双键,聚乙烯的结构简式为 ,
,
故答案为:CH2=CH2+Br2→CH2BrCH2Br; ;
;
(6)A.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键,不存在单双键的交替结构,故A正确;
B.苯分子里的6个碳原子和6个氢原子在同一个平面上,为平面正六边形,故B正确;
C.苯中不含双键,滴入溴水中,振荡后水层接近无色,不发生加成反应,发生萃取,故C错误;
故答案为:AB.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、速率计算及平衡判定、有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:N2(g)+6H2O(l)═4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量.化学上,规定标准状况下稳定单质的生成热为0.几种物质的生成热:NH3(g)为mkJ•mol-1,H2O(l)为nkJ•mol-1.
反应的△H=产物的生成热之和-反应物的生成热之和
②几种化学键的键能数据如下:
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
(2)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)?SO3(g)+NO(g),△H=-42kJ•mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%;
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”);
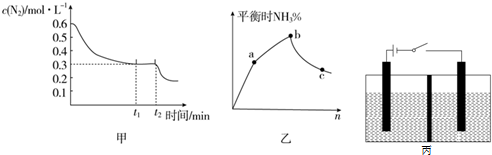
(3)对反应N2O4(g)?2NO2(g)△H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图1所示,下列说法正确的是d.

a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同),装置如图2所示,通电过程中,阳极区两种离子的放电产物会进一步发生反应,其方程式为:Cl2+CNO-+OH-→□+Cl-+CO32-+H2O(未配平).最终阴、阳两极均有无色无味气体产生.
①铁电极应连接直流电源的负极(填写电极名称).
②上述反应方程式配平后“□”内应填写N2;
③阳极上发生的电极反应为2Cl--2e-═Cl2↑和CN--2e-+2OH-=CNO-+H2O.
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示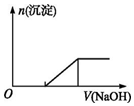 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
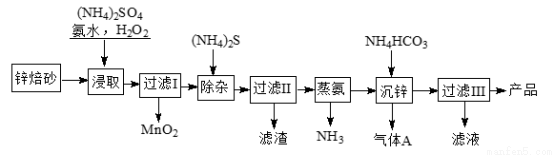
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.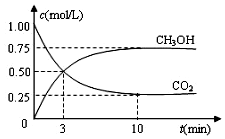 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.