题目内容
18. 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.(1)写出下列仪器的名称:a.蒸馏烧瓶 b.冷凝器(直形冷凝管) c. 容量瓶.
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是酒精灯,将仪器补充完整后进行实验,温度计水银球的位置在蒸馏烧瓶支管口处.冷凝水由g(填f或g)口通入.
(3)现需配制0.1mol/L CuSO4溶液450mL,装置II是某同学转移溶液的示意图.
①图中的错误是没有用玻璃棒引流.除图中给出的仪器和分析天平外,为完成实验还需的仪器有:玻璃棒和胶头滴管.
②根据计算得知,需称取的胆矾的质量为12.5g.
③在100mL某浓度的CuSO4溶液中加入一质量为45.0g的铁棒,反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g.若反应后溶液的体积不变,所得溶液中FeSO4的物质的量浓度为2mol/L.
分析 (1)由图可知仪器的名称;
(2)分离四氯化碳和酒精的混合物,选择蒸馏装置,需要酒精灯加热,温度计测定馏分的温度,冷却水下进上出;
(3)①转移液体需要引流;在烧杯中溶解、冷却后转移到容量瓶中定容;
②结合m=cVM计算;
③发生Fe+CuSO4=FeSO4+Cu及差量法计算.
解答 解:(1)由图可知仪器的名称为a.蒸馏烧瓶、b.冷凝器(直形冷凝管)、c.容量瓶,故答案为:蒸馏烧瓶;冷凝器(直形冷凝管);容量瓶;
(2)分离四氯化碳和酒精的混合物,选择蒸馏装置,需要酒精灯加热,则图中缺少仪器为酒精灯,温度计水银球的位置在蒸馏烧瓶支管口处.冷凝水由g口通入,
故答案为:酒精灯;蒸馏烧瓶支管口;g;
(3)①图中的错误是没有用玻璃棒引流;除图中给出的仪器和分析天平外,为完成实验还需的仪器有玻璃棒和胶头滴管,
故答案为:没有用玻璃棒引流;玻璃棒和胶头滴管;
②选择500mL容量瓶,需称取的胆矾的质量为0.5L×0.1mol/L×250g/mol=12.5 g,故答案为:12.5;
③Fe+CuSO4=FeSO4+Cu△m
1 8
n (46.6g-45.0g)
n=0.2mol,反应后溶液的体积不变,仍为0.1L,则所得溶液中FeSO4的物质的量浓度为$\frac{0.2mol}{0.1L}$=2 mol/L,
故答案为:2.
点评 本题考查混合物分离及溶液配制实验,为高频考点,把握仪器的使用、混合物分离提纯、溶液配制实验为解答的关键,侧重分析与实验能力的考查,注意差量法计算的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质中能抑制水的电离且使溶液呈现出酸性的是( )
| A. | Na2CO3 | B. | AlCl3 | C. | NaCl | D. | KHSO4 |
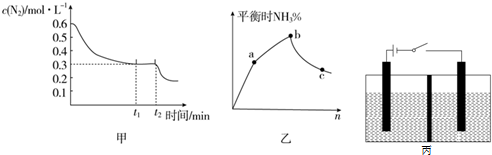
13. 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此合成反应的a>0;△S>0,(填“>”、“<”或“=”).
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
10.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示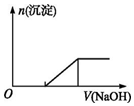 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
8.变质的油脂有难闻的哈喇味,这是因为发生了( )
| A. | 氧化反应 | B. | 加成反应 | C. | 还原反应 | D. | 水解反应 |