题目内容
20.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2△H>0.下列说法正确的是( )| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 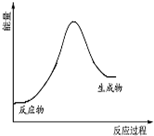 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
分析 A.H2、D2、T2三种均为氢气,不属于同素异形体;
B.铁的还原性强于氢气;
C.该反应为吸热反应,反应物能量低于生成物;
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,有3mol铁反应时转移8mol电子,则1mol铁反应则转移电子2mol.
解答 解:A.H2、D2、T2三种均为氢气,不属于同素异形体,故A错误;
B.铁的还原性强于氢气,故B错误;
C.该反应为吸热反应,反应物能量低于生成物,故C正确;
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,有3mol铁反应时转移8mol电子,则1mol铁反应则转移电子2mol,故D错误.
故选:C.
点评 本题考查了化学反应与能量变化,同素异形体的概念,电子转移数目的计算,注意对氧化还原反应的分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.尿素燃料电池既能去除城市废水中的尿素,又能发电.尿素燃料电池结构如图所示,甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,则( )
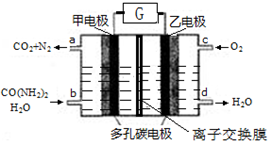

| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
8.下列实验设计、操作或实验现象不合理的是( )
| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
5.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
12.EDTA是一种重要的络合剂.4mol 一氯乙酸和1mol乙二胺(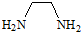 )在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )
)在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )
 )在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )
)在一定条件下发生反应生成1mol EDTA和4mol HCl,则EDTA的分子式为( )| A. | C10H16N2O8 | B. | C10H20N2O8 | C. | C8H16N2O8 | D. | C16H20N2O8Cl |
6.下列对化学用语的理解正确的是( )
| A. | ${\;}_8^{18}$O表示中子数为8的氧原子 | B. | 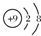 表示氟原子的结构示意图 表示氟原子的结构示意图 | ||
| C. | 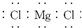 表示MgCl2的电子式 表示MgCl2的电子式 | D. | 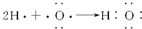 H表示H2O的形成过程 H表示H2O的形成过程 |
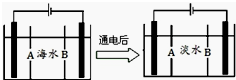 科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.
科研人员对某岛上山泉水进行分析化验,结果显示山泉水属于硬水.