题目内容
10.尿素燃料电池既能去除城市废水中的尿素,又能发电.尿素燃料电池结构如图所示,甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,则( )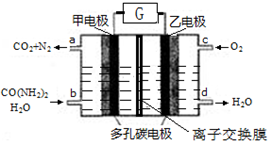
| A. | 甲电极是阴极 | B. | 电解质溶液可以是KOH溶液 | ||
| C. | H+从甲电极附近向乙电极附近迁移 | D. | 每2molO2理论上可净化1molCO(NH2)2 |
分析 A、甲电极CO(NH2)2失电子生成二氧化碳和氮气,是燃料电池的负极;
B.甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,该原电池是酸性电解质;
C.原电池中阳离子从原电池负极向正极迁移;
D.根据电池的总反应式进行计算.
解答 解:A.由题甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,甲电极是燃料电池的负极,故A错误;则原电池中阳离子向正极移动,则电池工作时H+移向正极,故A错误;
B.甲电极上发生如下反应:CO(NH2)2+H2O-6e→CO2+N2+6H+,该原电池是酸性电解质,电解质溶液不可以是KOH溶液,故B错误;
C.原电池中阳离子向正极移动,则电池工作时H+从甲电极(负极)附近向乙电极(正极)附近迁移,故C正确;
D.电池的总反应式为:2CO(NH2)2+3O2=2CO2+2N2+4H2O,则每2molO2理论上可净化4/3molCO(NH2)2,故D错误;
故选C.
点评 本题考查了原电池原理的应用,注意掌握电极方程式的书写是解决本题的关键,题目难度中等.

练习册系列答案
相关题目
13.有机物 又名萘,则萘的化学式为( )
又名萘,则萘的化学式为( )
 又名萘,则萘的化学式为( )
又名萘,则萘的化学式为( )| A. | C10H10 | B. | C10H8 | C. | C12H10 | D. | C10H12 |
1.关于有机化学实验说法正确的是( )
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
5.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
| A. | 钒、铬、锰、铁等难熔金属通常采用铝热法炼制 | |
| B. | 炼钢和炼铁都是采用还原剂将铁从其化合物中还原出来,区别在于炼钢时选用的还原剂的还原性更强 | |
| C. | 由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质 | |
| D. | 炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳 |
15.某未知溶液(只含一种溶质)中加入醋酸钠固体后,测得溶液中c(CH3COO-):c(Na+)=1:1.则原未知溶液一定不是( )
| A. | 强酸溶液 | B. | 弱酸性溶液 | C. | 弱碱性溶液 | D. | 强碱溶液 |
2.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.说法正确的是( )
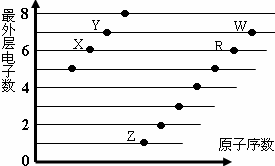

| A. | 元素非金属性:X>R>W | |
| B. | X与R形成的分子内含两种作用力 | |
| C. | X、Z形成的化合物中可能含有共价键 | |
| D. | 元素对应的离子半径:W>R>X |
19.关于热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1的叙述正确的是( )
| A. | 一分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1mol H2和Cl2完全反应生成2mol HCl放出的热量为184.6kJ | |
| C. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,放出的热量为184.6 kJ | |
| D. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,吸收的热量为184.6kJ |
20.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2△H>0.下列说法正确的是( )
| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 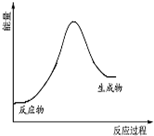 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.