题目内容
6.下列对化学用语的理解正确的是( )| A. | ${\;}_8^{18}$O表示中子数为8的氧原子 | B. | 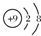 表示氟原子的结构示意图 表示氟原子的结构示意图 | ||
| C. | 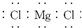 表示MgCl2的电子式 表示MgCl2的电子式 | D. | 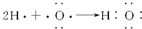 H表示H2O的形成过程 H表示H2O的形成过程 |
分析 A.中子数=质量数-质子数,该氧原子的中子数为:14-8=6,;
B.氟原子核电荷数为9,核外电子总数为9,最外层电子数为7;
C.氯离子不能合并,应该拆开分别写在镁离子两边;
D.氢原子和氧原子之间以共用电子对而形成水分子.
解答 解:A.该原子为氧原子,其质量数为14,质子数为8,则中子数=14-8=6,故A错误;
B.氟原子的核外电子总数为9,最外层为7个电子,故B错误;
C.氯化镁为离子化合物,电子式中需要标出阴阳离子所带电荷,氯离子应该写在镁离子两边,氯化镁制取的电子式为: ,故C错误;
,故C错误;
D.H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为 ,故D正确,故选D.
,故D正确,故选D.
点评 本题考查了电子式、离子结构示意图的表示方法的判断,题目难度中等,注意掌握常见的化学用语的概念及正确的表示方法,明确离子结构示意图与原子结构示意图的区别.

练习册系列答案
相关题目
20.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2△H>0.下列说法正确的是( )
| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 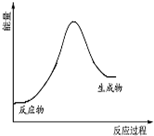 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
1.下列各组中的性质比较,不正确的是( )
| A. | 水溶性:SO2>Cl2>CO2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3>H2O>HF | D. | 沸点:F2<Cl2<Br2<I2 |
18.从矿物学资料查得,当胆矾溶液渗人地下,遇黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4,下列有关叙述中正确的是( )
| A. | 在反应中,FeS2是氧化剂,不是还原剂 | |
| B. | 在反应中,CuSO4是氧化剂,FeS2是还原剂 | |
| C. | 反应中Cu2+与FeS2的物质的量之比是14:5 | |
| D. | 反应中每生成1mol Cu2S共得2mol电子 |
1.下列各元素中,一定属于主族元素的是( )
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素原子最外层电子数为2 | |
| C. | Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 | |
| D. | R元素的最高价氧化物是酸性氧化物 |
11.常温下,0.05mol•L-1Ba(OH)2溶液的pH为( )
| A. | 13 | B. | 1 | C. | 1.3 | D. | 12.7 |
15.乙醛(CH3CHO)、乙酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含氢的质量分数为( )
| A. | $\frac{6A%}{7}$ | B. | $\frac{1-A%}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
16.1mol有机物甲,水解后得2molC2H6O和1molC2H2O4,该有机物是( )
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
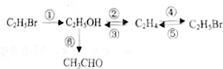
 ②CH3CH2OH
②CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O CH3CH2Br 乙醛的银镜反应
CH3CH2Br 乙醛的银镜反应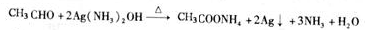
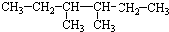 .
.