题目内容
8.下列实验设计、操作或实验现象不合理的是( )| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
分析 A.Fe3+和KSCN溶液反应产生血红色溶液,Fe2+和KACN不反应,氯气具有强氧化性,能氧化Fe2+生成Fe3+;
B.银镜反应必须在碱性条件下进行;
C.甲酸钠中含有醛基;
D.溴乙烷中溴元素检验时,先将溴原子转化为溴离子,在酸性条件下用硝酸银溶液检验溴离子.
解答 解:A.Fe3+和KSCN溶液反应产生血红色溶液,Fe2+和KACN不反应,氯气具有强氧化性,能氧化Fe2+生成Fe3+,
取某试样溶液少量,加入KSCN溶液无明显现象,说明不含铁离子,再滴入几滴氯水,若溶液显血红色,说明含有亚铁离子,故A正确
B.银镜反应必须在碱性条件下进行,所以在加银氨溶液之前必须加碱中和未反应的酸,故B正确;
C.甲酸钠中含有醛基,所以不能用银镜反应或新制氢氧化铜悬浊液检验甲醛,故C错误;
D.溴乙烷中溴元素检验时,先将溴原子转化为溴离子,在酸性条件下用硝酸银溶液检验溴离子,根据是否产生淡黄色沉淀判断是否含有溴元素,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及官能团检验、离子检验、物质鉴别等知识点,明确实验原理及物质性质是解本题关键,注意实验操作先后顺序及反应条件,易错选项是C.

练习册系列答案
相关题目
19.关于热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1的叙述正确的是( )
| A. | 一分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1mol H2和Cl2完全反应生成2mol HCl放出的热量为184.6kJ | |
| C. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,放出的热量为184.6 kJ | |
| D. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,吸收的热量为184.6kJ |
16.苹果酯的结构简式如图所示,下列说法不正确的是( )
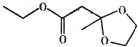

| A. | 苹果酯分子中含有14个氢原子 | |
| B. | 苹果酯能在NaOH溶液中发生水解反应 | |
| C. | 苹果酯能与金属钠反应产生氢气 | |
| D. | 苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体 |
20.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2△H>0.下列说法正确的是( )
| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 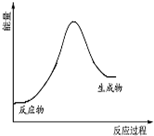 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
17.天然气脱硫的方法有多种,一种是干法脱硫,其涉及的反应:H2(g)+CO(g)+SO2(g)?H2O(g)+CO2(g)+S(s)+Q(Q>0).要提高脱硫率可采取的措施是( )
| A. | 加催化剂 | B. | 分离出硫 | C. | 减压 | D. | 加生石灰 |
18.从矿物学资料查得,当胆矾溶液渗人地下,遇黄铁矿(FeS2)时可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4,下列有关叙述中正确的是( )
| A. | 在反应中,FeS2是氧化剂,不是还原剂 | |
| B. | 在反应中,CuSO4是氧化剂,FeS2是还原剂 | |
| C. | 反应中Cu2+与FeS2的物质的量之比是14:5 | |
| D. | 反应中每生成1mol Cu2S共得2mol电子 |
 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.