题目内容
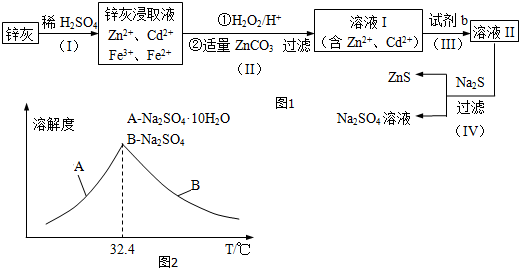
15.氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-.研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度.
回答下列问题:
(1)检查装置气密性后,添加药品,待装置Ⅲ水温升至75℃开始反应.
①装置Ⅰ的作用是制备Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②若取消装置Ⅱ,对本实验的影响是杂质HCl气体消耗氢氧化钾,使KClO3产率降低.
③实验结束,拆解装置Ⅰ前为了防止大量氯气逸出,可采取的措施是将装置Ⅳ中的溶液从分液漏斗中注入圆底烧瓶.
④从装置Ⅲ的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和KCl.
(2)已知碱性条件下,ClO-有强氧化性,而ClO3-氧化性很弱.设计实验证明:碱性条件下,H2O2能被ClO-氧化,而不能被ClO3-氧化分别取少量NaClO和NaClO3溶液于试管AB中,均滴加少量NaOH溶液,再分别滴加H2O2溶液,A中有气泡产生并能使带火星的木条复燃,B中无明显现象.
(3)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液.
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10,滴加足量H2O2溶液充分振荡,然后煮沸溶液1~2分钟,冷却.
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸.(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.(2S2O32-+I2=S4O62-+2I-)
①步骤2的目的是除去ClO-.写出煮沸时反应的化学方程式2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
②样品中KClO3的质量分数为83.3%.(KClO3式量:122.5)
分析 氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-.利用装置Ⅰ制备氯气,通过装置Ⅱ中的饱和Ⅱ水除去氯气中杂质气体HCl,氯气通入装置Ⅲ的d装置中的氢氧化钾溶液控制温度75℃以上发生反应生成氯酸钾,剩余氯气通过装置Ⅳ中的氢氧化钠溶液吸收过量氯气,避免污染空气,
(1)①Ⅰ中是二氧化锰和浓盐酸加热反应生成氯气的发生装置;
②装置Ⅱ是饱和食盐水用来除去氯气中的氯化氢气体,避免影响生成氯酸钾的产量;
③拆解装置Ⅰ前为了防止大量氯气逸出,可以利用装置Ⅳ中的氢氧化钠溶液从分液漏斗加入吸收剩余的氯气;
④在75℃以上氯气和浓碱溶液中主要产物是ClO3-和Cl-,所以混有杂质为氯化钾;
(2)已知碱性条件下,ClO-有强氧化性,而ClO3-氧化性很弱,碱性条件下,H2O2能被ClO-氧化,而不能被ClO3-氧化,结合生成产物的性质和检验设计实验方案;
①测定产品KClO3的纯度,样品中含次氯酸钾,加入过氧化氢会和次氯酸根离子发生反应,煮沸过程中过氧化氢分解生成水和氧气;
②ClO3-+6I-+6H+=Cl-+3I2+3H2O,2S2O32-+I2=S4O62-+2I-,依据离子方程式定量关系计算,注意溶液体积的变化.
解答 解:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO3-和Cl-.利用装置Ⅰ制备氯气,通过装置Ⅱ中的饱和Ⅱ水除去氯气中杂质气体HCl,氯气通入装置Ⅲ的d装置中的氢氧化钾溶液控制温度75℃以上发生反应生成氯酸钾,剩余氯气通过装置Ⅳ中的氢氧化钠溶液吸收过量氯气,避免污染空气,
(1)①Ⅰ中是二氧化锰和浓盐酸加热反应生成氯气的发生装置,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:Cl2;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②装置Ⅱ是饱和食盐水用来除去氯气中的氯化氢气体,避免影响生成氯酸钾的产量,若取消装置Ⅱ,对本实验的影响是杂质HCl气体消耗氢氧化钾,使KClO3产率降低,
故答案为;杂质HCl气体消耗氢氧化钾,使KClO3产率降低;
③拆解装置Ⅰ前为了防止大量氯气逸出,可以利用装置Ⅳ中的氢氧化钠溶液从分液漏斗加入吸收剩余的氯气,Cl2+2NaOH=NaCl+NaClO+H2O,将装置Ⅳ中的溶液从分液漏斗中注入圆底烧瓶吸收剩余氯气,
故答案为:将装置Ⅳ中的溶液从分液漏斗中注入圆底烧瓶;
④在75℃以上氯气和浓碱溶液中主要产物是ClO3-和Cl-,所以混有杂质为氯化钾,
故答案为:KCl;
(2)已知碱性条件下,ClO-有强氧化性,而ClO3-氧化性很弱,碱性条件下,H2O2能被ClO-氧化,而不能被ClO3-氧化,结合生成产物的性质和检验设计实验方案;
①测定产品KClO3的纯度,样品中含次氯酸钾,加入过氧化氢会和次氯酸根离子发生反应,步骤2的目的是除去ClO-,煮沸过程中过氧化氢分解生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,
故答案为:除去ClO-;2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑;
②ClO3-+6I-+6H+=Cl-+3I2+3H2O,2S2O32-+I2=S4O62-+2I-,依据离子方程式定量关系计算,
ClO3-~3I2~6S2O32-,
1 6
n 0.5000mol•L-1 ×0.02000L
n=$\frac{0.01}{6}$mol,
250ml溶液中所含KClO3的物质的量=$\frac{0.01}{6}$mol×$\frac{250}{25}$=$\frac{0.1}{6}$mol,
2.45g样品中KClO3的含量=$\frac{\frac{0.1}{6}mol×122.5g/mol}{2.45g}$×100%=83.3%,
故答案为:83.3%.
点评 本题考查了物质组成、物质成分的实验探究分析,实验探究、实验步骤、实验计算等知识点,主要是氧化还原反应产物的生成和判断,掌握基础是解题关键,题目难度中等.

| A. | 钒、铬、锰、铁等难熔金属通常采用铝热法炼制 | |
| B. | 炼钢和炼铁都是采用还原剂将铁从其化合物中还原出来,区别在于炼钢时选用的还原剂的还原性更强 | |
| C. | 由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质 | |
| D. | 炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳 |
| A. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1 mol有机物 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基( 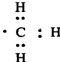 )所含的电子数为7 NA )所含的电子数为7 NA |
| A. | b-3 | B. | b+5 | C. | b+4 | D. | b一11 |
| A. | 元素H的单质存在H2、D2、T2三种同素异形体 | |
| B. | 在该反应条件下,H2的还原性强于Fe的还原性 | |
| C. | 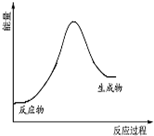 该反应的能量变化关系可以用如图表示 | |
| D. | 1molFe与水蒸气完全反应转移的电子数为3×6.02×1023 |
| 序号 | 实验操作 | 实验目的 |
| A | 在浓硫酸和稀硫酸中分别加入Cu片,加热 | 比较稀、浓硫酸氧化性强弱 |
| B | F2、Cl2分别与H2反应 | 比较氟、氯的非金属性强弱 |
| C | 把CO2通入到水玻璃中 | 比较碳、硅的非金属性强弱 |
| D | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素原子最外层电子数为2 | |
| C. | Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 | |
| D. | R元素的最高价氧化物是酸性氧化物 |