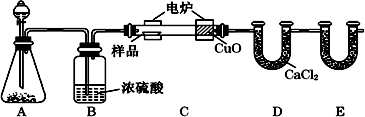
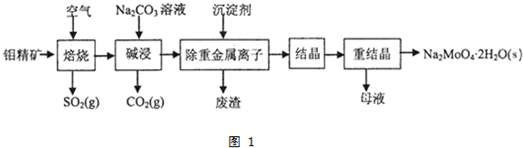
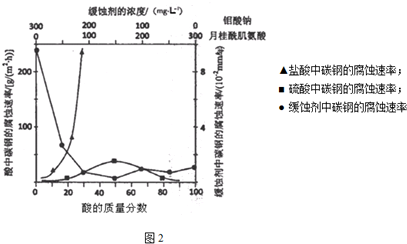
题目内容
14.N A为阿伏加德罗常数,下列说法正确的是( )| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.1mol•L-1NaCl溶液中Na+的数目为0.1NA | |
| C. | 11.2 LCO2所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
分析 A.18gD2O和18gH2O的物质的量分别是0.9mol、1mol,两种分子中质子数都是10;
B.溶液体积未知导致无法计算n(NaCl);
C.温度和压强未知导致无法确定气体摩尔体积,则无法计算气体物质的量;
D.乙烯、丙烯和丁烯的最简式都是CH2,混合气体14g中n(CH2)=$\frac{14g}{14g/mol}$=1mol,每个CH2中含有3个原子.
解答 解:A.18gD2O和18gH2O的物质的量分别是0.9mol、1mol,两种分子中质子数都是10,则两种物质的质子数分别是9NA和10NA,故A错误;
B.溶液体积未知导致无法计算n(NaCl),则无法计算钠离子个数,故B错误;
C.温度和压强未知导致无法确定气体摩尔体积,则无法计算气体物质的量,所以无法计算二氧化碳分钟数,故C错误;
D.乙烯、丙烯和丁烯的最简式都是CH2,混合气体14g中n(CH2)=$\frac{14g}{14g/mol}$=1mol,每个CH2中含有3个原子,所以其原子数为3 NA,故D正确;
故选D.
点评 本题以阿伏伽德罗常数为载体考查物质的量计算,为高频考点,侧重考查学生分析计算能力,明确物质构成、物质的量基本公式是解本题关键,易错选项是C.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
4.以下物质间的转化不能通过一步反应就能实现的是( )
| A. | Fe(OH)3→Fe2O3→Fe | B. | NH3→NO→NO2→HNO3 | C. | S→SO3→H2SO4 | D. | Cl2→HClO→NaClO |
2.下列各组物质,互为同系物的是( )
| A. | CH3CH=CH2与 | B. | 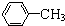 与 与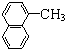 | ||
| C. | CH3CH2Cl 与CH3CHClCH2Cl | D. | 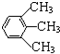 与 与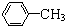 |
9.中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示,下列叙述不正确的是( )
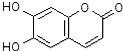

| A. | M的相对分子质量是172 | |
| B. | 1mol M最多能与3mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1mol M与足量Na反应能生成1mol H2 |
1.只用一种试剂就能将甲苯、己烯、四氯化碳、碘化钾溶液区别开,该试剂可以是( )
| A. | KMnO4溶液 | B. | KBr溶液 | C. | 溴水 | D. | AgNO3溶液 |
6.下列有关阿伏伽德罗常数NA的判断正确的是( )
| A. | 标准状况下,2.24L氯仿(CHCl3)含0.4NA个共价键 | |
| B. | 1molNaHSO4固体含3NA个离子 | |
| C. | NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子 | |
| D. | 反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有71gCl2生成时,转移0.5NA个电子 |
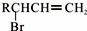 .
.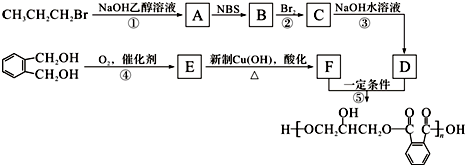
 ,C的名称是1,2,3-三溴丙烷.
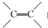
,C的名称是1,2,3-三溴丙烷.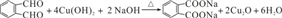 ;
;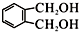 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种. .
.