题目内容
5.钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图1: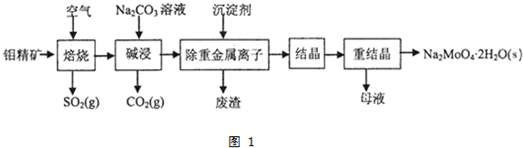
(1)写出“碱浸”反应的离子方程式:MoO3+CO32-=MoO42-+CO2↑.
(2)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率是97.3%.[已知:碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.04mol•L-1,Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略.]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度.
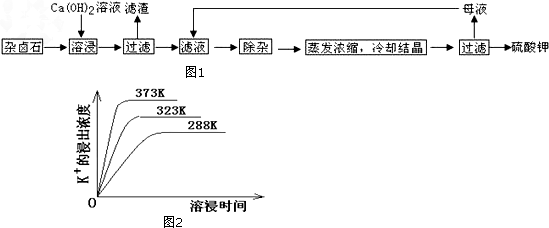
(4)图2是碳钢在3种不同介质中的腐蚀速率实验结果:
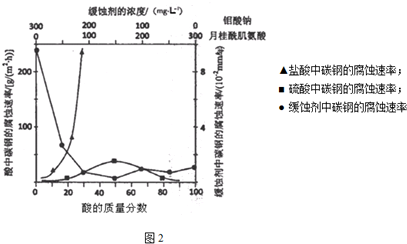
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀(或硫酸溶液随着浓度的增大,氧化性增强,会使钢铁钝化,腐蚀速率减慢).
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2.NaNO2的作用是替代空气中氧气起氧化剂作用.
③若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为7.28×l0-4mol•L-1.
分析 (1)焙烧后生成的三氧化钼与碳酸钠反应生成了MoO42-;
(2)根据钼酸呗和硫酸钡的溶度积计算出溶液中硫酸根离子的浓度,在再计算出SO42-的去除率;
(3)使用的次数较多后,母液中杂质的浓度增大,影响产品纯度;
(4)①根据图示数据分析碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异的原因;
②根据NaNO2具有氧化性的化学性质进行分析;
③根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处,即钼酸钠的浓度150mg•L-1,据此计算出钼酸钠的物质的量浓度.
解答 解:(1)三氧化钼与碳酸钠反应生成了MoO42-,反应的离子方程式为:MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(2)BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=$\frac{4.0×1{0}^{-8}}{0.40mol/L}$=1×10-7mol/L,
溶液中硫酸根离子的浓度为:c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-7}}$mol/L=1.1×10-3mol/L,
硫酸根离子的去除率为:1-$\frac{1.1×1{0}^{-3}}{0.04}$×100%=1-2.75%≈97.3%,
故答案为:97.3%;
(3)由于使用的次数较多后,母液中杂质的浓度增大,影响产品纯度,所以进行必须净化处理,
故答案为:使用一定次数后,母液中杂质的浓度增大,重结晶时会析出杂质,影响产品纯度;
(4)①由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀(或硫酸溶液随着浓度的增大,氧化性增强,会使钢铁钝化,腐蚀速率减慢);
②NaNO2的具有氧化性,能够在钢铁表面形成FeMoO4-Fe2O3保护膜,
故答案为:替代空气中氧气起氧化剂作用;
③根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,
所以钼酸钠的浓度为:150mg•L-1,
1L溶液中含有的钼酸钠物质的量为:$\frac{150×1{0}^{-3}g}{206g/mol}$≈7.28×10-4mol,
所以钼酸钠溶液的物质的量浓度为:7.28×l0-4mol•L-1,
故答案为:7.28×l0-4mol•L-1.
点评 本题通过制备钼酸钠晶体的方法,考查了制备方案的设计,题目难度中等,注意分析题中图示是解题关键,最后一问有一定的难度,容易出错,需要合理应用题中数据,试题培养了学生的分析、理解能力及化学实验能力.

| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.1mol•L-1NaCl溶液中Na+的数目为0.1NA | |
| C. | 11.2 LCO2所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
①石灰水 ②酸性KMnO4溶液 ③溴水 ④用硝酸酸化的Ba(NO3)2溶液 ⑤品红溶液.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |
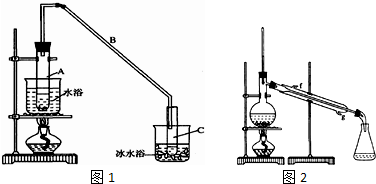
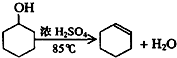
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A采用水浴加热的优点是均匀受热,容易控制反应温度.
②试管C置于冰水浴中的目的是试管C置于冰水浴中.
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c(填字母,单选)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填g或f).蒸馏时要加入生石灰,目的是生石灰吸收水分,便于蒸馏出更纯净的产品.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母,单选).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如图),每个碳原子通过sp2杂化与周围碳原子成键.
碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如图),每个碳原子通过sp2杂化与周围碳原子成键.