题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.多元弱酸根离子分步水解,且水解程度依次减小;
B.电荷不守恒;
C.二者反应生成碘和水;
D.氢氧化铝不溶于弱酸.
B.电荷不守恒;
C.二者反应生成碘和水;
D.氢氧化铝不溶于弱酸.
解答:
解:A.多元弱酸根离子分步水解,且水解程度依次减小,其水解方程式为CO32-+H2O?HCO3-+OH-,故A错误;
B.电荷不守恒,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.二者反应生成碘和水,离子方程式为2I-+H2O2+2H+═I2+2H2O,故C错误;
D.氢氧化铝不溶于弱酸,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选D.
B.电荷不守恒,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.二者反应生成碘和水,离子方程式为2I-+H2O2+2H+═I2+2H2O,故C错误;
D.氢氧化铝不溶于弱酸,离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D正确;
故选D.
点评:本题考查了离子方程式的书写,为高考高频点,明确物质发生的反应是解本题关键,易错选项是C,注意一下几点:
1.多元弱酸分步水解,多元弱碱也是分步水解,但写总的水解方程式;
2.在酸性条件下不能生成氢氧根离子、在碱性条件下不能生成氢离子;
3.有的反应与反应物的量有关,反应物的量不同,其产物不同.
1.多元弱酸分步水解,多元弱碱也是分步水解,但写总的水解方程式;
2.在酸性条件下不能生成氢氧根离子、在碱性条件下不能生成氢离子;
3.有的反应与反应物的量有关,反应物的量不同,其产物不同.

练习册系列答案
相关题目
炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
| A、铁 | B、硫 | C、氧 | D、碳 |
某反应的△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能不小于100kJ?mol-1 |
| B、正反应活化能小于100kJ?mol-1 |
| C、逆反应活化能一定小于100kJ?mol-1 |
| D、正反应活化能比逆反应活化能小100kJ?mol-1 |
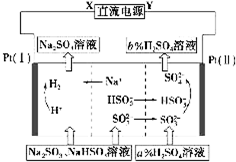 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )| A、X为直流电源的正极,Y为直流电源的负极 |
| B、阳极区pH减小 |
| C、图中的b<a |
| D、阴极的电极反应为HSO3--2e-+H2O═SO42-+3H+和SO32--2e-+2H2O═SO42-+4H+ |
人的血液中存在H2CO3~HCO3-这样“一对”物质,前者的电离和后者的水解两个平衡使正常人血液的pH保持在7.35~7.45之间.血液中注射碱性物质时,上述电离和水解受到的影响分别是( )
| A、促进、促进 |
| B、促进、抑制 |
| C、抑制、促进 |
| D、抑制、抑制 |
下列离子方程式正确的是( )
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
| C、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
| D、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
下列对金、银、铜的描述错误的是( )
| A、金具有极高的抗腐蚀性、优良的导热、导电性 |
| B、银可用作有机合成催化剂、电池等材料 |
| C、Cu属于不活泼金属,在潮湿的空气中不易被腐蚀 |
| D、铜具有良好的导电性,大量用于制造电线、电缆 |
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3+Cu═2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液组成的判断正确的是( )
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Fe2+):c(Cu2+)=2:1 |
| C、c(Fe2+):c(Fe3+)=3:1 |
| D、c(Cl-)=6mol/L,c(Fe2+)=0.6mol/L |