题目内容
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3+Cu═2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液组成的判断正确的是( )
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Fe2+):c(Cu2+)=2:1 |
| C、c(Fe2+):c(Fe3+)=3:1 |
| D、c(Cl-)=6mol/L,c(Fe2+)=0.6mol/L |
考点:化学方程式的有关计算
专题:计算题
分析:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g,沉淀为AgCl,n(Cl-)=
=0.06mol,c(Cl-)=6mol/L,阴离子只此一种,带负电荷量也是0.06mol,则没加含铜绝缘板时应含有Fe3+ 0.02mol(电荷守恒);
由(2)加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol,铜片质量减少了0.256g,即
=0.004mol,根据铜片减少的质量结合方程式计算溶液中Fe3+的物质的量,进而计算原废液中c(Fe3+);
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),据此计算原废液中c(Fe2+)、c(Cu2+),以此来解答.
| 8.61g |
| 143.5g/mol |
由(2)加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol,铜片质量减少了0.256g,即
| 0.256g |
| 64g/mol |
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),据此计算原废液中c(Fe2+)、c(Cu2+),以此来解答.
解答:
解:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g,沉淀为AgCl,n(Cl-)=
=0.06mol,c(Cl-)=6mol/L,阴离子只此一种,带负电荷量也是0.06mol,则没加含铜绝缘板时应含有Fe3+ 0.02mol(电荷守恒);
由(2)加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol,铜片质量减少了0.256g,即
=0.004mol,令10mL废液中Fe3+为nmol,则:
2FeCl3+Cu═2FeCl2+CuCl
2 1
nmol 0.004
故n=0.008mol,所以原废液中c(Fe3+)=
0.8mol/L,
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),原废液中c(Cl-)=6mol/L,故3×0.8+2c(Fe2+)+2×
c(Fe2+)=6,解得c(Fe2+)=1.2mol/L,故原废液中c(Fe2+):c(Fe3+)=1.2mol/L:0.8mol/L=3:2,
A.废液放入铜片充分反应,铜片质量减少了0.256g,说明溶液中含有Fe3+,结合反应2FeCl3+Cu═2FeCl2+CuCl2可知,原废液一定含有Fe2+、Fe3+、Cu2+、Cl-,故A正确;
B.由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),故B正确;
C.由上述分析可知,c(Fe2+):c(Fe 3+)=3:2,故C错误;
D.由上述分析可知,c(Cl-)=6mol/L,c(Fe2+)=1.2mol/L,故D错误;
故选AB.
| 8.61g |
| 143.5g/mol |
由(2)加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol,铜片质量减少了0.256g,即
| 0.256g |
| 64g/mol |
2FeCl3+Cu═2FeCl2+CuCl
2 1
nmol 0.004
故n=0.008mol,所以原废液中c(Fe3+)=
| 0.008mol |
| 0.01L |
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),原废液中c(Cl-)=6mol/L,故3×0.8+2c(Fe2+)+2×
| 1 |
| 2 |
A.废液放入铜片充分反应,铜片质量减少了0.256g,说明溶液中含有Fe3+,结合反应2FeCl3+Cu═2FeCl2+CuCl2可知,原废液一定含有Fe2+、Fe3+、Cu2+、Cl-,故A正确;
B.由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),故B正确;
C.由上述分析可知,c(Fe2+):c(Fe 3+)=3:2,故C错误;
D.由上述分析可知,c(Cl-)=6mol/L,c(Fe2+)=1.2mol/L,故D错误;
故选AB.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的化学反应及电荷守恒、原子守恒为解答的关键,侧重分析能力、计算能力的考查,题目难度较大.

练习册系列答案
相关题目
等质量的铁屑和锌粒与足量的同浓度的稀硫酸反应,下列图象可能正确的是( )
A、 |
B、 |
C、 |
D、 |
下列表示对应化学反应的离子方程式正确的是( )
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
下列说法正确的是( )
| A、可用使铁钝化的方法来减缓铁的腐蚀 |
| B、除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C、不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D、等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
下列实验过程和过程中涉及的离子反应方程式正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- |
| B、Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3HBr═Fe3++3Br-+3H2O |
| C、用氨水吸收烟道气中的SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、上述图示的反应为吸热反应 |
| B、图中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据①②推知:在25℃,101kPa时,1mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应676.7kJ |
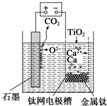 如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )| A、阳极反应式为C+2O2--4e-═CO2↑ |
| B、由TiO2制得1mol金属Ti,理论上外电路转移4mol电子 |
| C、制备金属钛前后,装置中CaO的量不变 |
| D、TiO2在阴极放电 |