题目内容
某反应的△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能不小于100kJ?mol-1 |
| B、正反应活化能小于100kJ?mol-1 |
| C、逆反应活化能一定小于100kJ?mol-1 |
| D、正反应活化能比逆反应活化能小100kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:根据在可逆反应过程中活化能有正反应和逆反应两种,焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能;△H>0,则反应物的总能量小于生成物的总能量.
解答:
解:
A、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,正反应活化能不小于100kJ?mol-1,故A正确;
B、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,正反应活化能不小于100kJ?mol-1,故B错误;
C、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,无法确定逆反应活化能的大小,故C错误;
D、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,即正反应活化能比逆反应活化能大100 kJ?mol-1,故D错误;
故选:A.
A、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,正反应活化能不小于100kJ?mol-1,故A正确;
B、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,正反应活化能不小于100kJ?mol-1,故B错误;
C、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,无法确定逆反应活化能的大小,故C错误;
D、某反应的△H=+100kJ?mol-1,则正反应的活化能-逆反应的活化能=+100kJ?mol-1,即正反应活化能比逆反应活化能大100 kJ?mol-1,故D错误;
故选:A.
点评:本题主要考查了焓变与活化能的关系,需要注意的是活化能有正反应和逆反应两种.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L?min) |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为60% |
| D、实验④中,达到平衡时,b>0.060 |
等质量的铁屑和锌粒与足量的同浓度的稀硫酸反应,下列图象可能正确的是( )
A、 |
B、 |
C、 |
D、 |
下列说法正确的是( )
| A、SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B、浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍.下列说法不正确的是( )
| A、元素Z、W的简单离子的电子层结构相同 |
| B、元素Y的简单气态氢化物的热稳定性比Z的弱 |
| C、由X、Y、Z三种元素形成化合物,其水溶液可能显碱性 |
| D、W、Z两种元素形成的化合物中肯定不含共价键 |
下列图示实验现象及其解释不正确的是( )
A、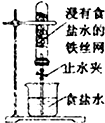 一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
B、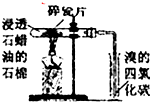 加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
C、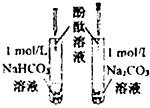 溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
D、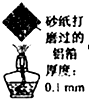 加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
下列表示对应化学反应的离子方程式正确的是( )
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+
| 1 |
| 2 |
下列说法正确的是( )
| A、上述图示的反应为吸热反应 |
| B、图中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据①②推知:在25℃,101kPa时,1mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应676.7kJ |
