题目内容
人的血液中存在H2CO3~HCO3-这样“一对”物质,前者的电离和后者的水解两个平衡使正常人血液的pH保持在7.35~7.45之间.血液中注射碱性物质时,上述电离和水解受到的影响分别是( )
| A、促进、促进 |
| B、促进、抑制 |
| C、抑制、促进 |
| D、抑制、抑制 |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:盐类的水解专题
分析:碳酸电离的离子方程式为:H2CO3 ?HCO3-+H+; 碳酸氢根水解的离子方程式为:HCO3-+H20?H2CO3+0H-,结合浓度对化学平衡移动的影响解答.
解答:
解:向血液中注射碱性物质时,氢氧根离子浓度增大.
碳酸电离的离子方程式为:H2CO3?HCO3-+H+; 增大氢氧根离子浓度,消耗氢离子,平衡向正向移动,促进碳酸的电离;
碳酸氢根水解的离子方程式为:HCO3-+H20?H2CO3+0H-,增大氢氧根离子浓度,平衡向逆向移动,抑制碳酸氢根离子的水解,
故选:B.
碳酸电离的离子方程式为:H2CO3?HCO3-+H+; 增大氢氧根离子浓度,消耗氢离子,平衡向正向移动,促进碳酸的电离;
碳酸氢根水解的离子方程式为:HCO3-+H20?H2CO3+0H-,增大氢氧根离子浓度,平衡向逆向移动,抑制碳酸氢根离子的水解,
故选:B.
点评:本题考查了弱电解的电离和盐类水解的影响因素,题目难度不大,熟悉弱电解质电离和盐类水解的实质,清楚浓度对化学平衡移动的影响是解题的关键.

练习册系列答案
相关题目
关于化学计量的应用,下列说法正确的是( )
| A、室温下,106g碳酸钠固体所含有的离子总的物质的量小于3mol |
| B、在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 |
| C、将物质的量浓度分别为1mol/L和2mol/L的硫酸等质量混合(假设体积可以加和),则混合后硫酸溶液的浓度为1.5mol/L |
| D、标况下,22.4L CH3Cl分子数约为6.02×1023 |
下列说法正确的是( )
| A、SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B、浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
下列图示实验现象及其解释不正确的是( )
A、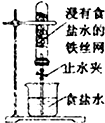 一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
B、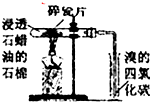 加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
C、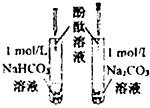 溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
D、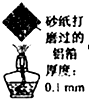 加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
贝诺酯是解热镇痛抗炎药,其结构如图所示.下列有关说法正确的是( )
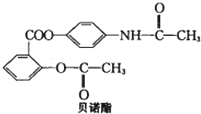

| A、分子式为C17H14O5N |
| B、在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C、1mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D、贝诺酯既属于酯类又属于蛋白质类 |
下列表示对应化学反应的离子方程式正确的是( )
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
下列装置能达到实验目的是( )


| A、除去乙醇中的苯酚 |
| B、制取金属锰 |
| C、实验室制氨气 |
| D、从碘的CCl4溶液中分离I2 |
下列说法正确的是( )
| A、可用使铁钝化的方法来减缓铁的腐蚀 |
| B、除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C、不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D、等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
 氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.