题目内容
下列离子方程式正确的是( )
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
| C、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
| D、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、浓盐酸中氯化氢全部电离;
B、硫代硫酸钠和酸反应生成二氧化硫、单质硫和水;
C、过氧化氢在酸性溶液中氧化碘离子为碘单质;
D、磁性氧化铁为四氧化三铁,氧化物在离子方程式中不能拆,和硝酸反应生成硝酸铁、一氧化氮和水.
B、硫代硫酸钠和酸反应生成二氧化硫、单质硫和水;
C、过氧化氢在酸性溶液中氧化碘离子为碘单质;
D、磁性氧化铁为四氧化三铁,氧化物在离子方程式中不能拆,和硝酸反应生成硝酸铁、一氧化氮和水.
解答:
解:A、MnO2与浓盐酸反应制Cl2:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故A错误;
B、Na2S2O3溶液中加入稀硫酸反应生成二氧化硫、单质硫和水:S2O32-+2H+═SO2↑+S↓+H2O,故B错误;
C、双氧水中加入稀硫酸和KI溶液反应生成碘单质:H2O2+2H++2I-═I2+2H2O,故C正确;
D、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故D错误;
故选C.
| ||
B、Na2S2O3溶液中加入稀硫酸反应生成二氧化硫、单质硫和水:S2O32-+2H+═SO2↑+S↓+H2O,故B错误;
C、双氧水中加入稀硫酸和KI溶液反应生成碘单质:H2O2+2H++2I-═I2+2H2O,故C正确;
D、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故D错误;
故选C.
点评:本题考查了联系方程式书写方法和注意问题,主要是氧化还原反应产物的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列实验操作不正确的是( )
| A、分液时,分液漏斗中上层液体应从漏斗口倒出 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、蒸发时,当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍.下列说法不正确的是( )
| A、元素Z、W的简单离子的电子层结构相同 |
| B、元素Y的简单气态氢化物的热稳定性比Z的弱 |
| C、由X、Y、Z三种元素形成化合物,其水溶液可能显碱性 |
| D、W、Z两种元素形成的化合物中肯定不含共价键 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下,0.56L丙烷中含有共价键的数目为0.2NA |
| B、常温常压下,6.4g氧气和臭氧中含有的分子总数为0.2NA |
| C、1mol羟基中电子数为10NA |
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
下列表示对应化学反应的离子方程式正确的是( )
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
下列实验过程和过程中涉及的离子反应方程式正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- |
| B、Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3HBr═Fe3++3Br-+3H2O |
| C、用氨水吸收烟道气中的SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
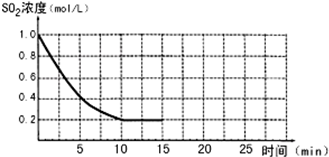 已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.