题目内容
 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )| A、X为直流电源的正极,Y为直流电源的负极 |
| B、阳极区pH减小 |
| C、图中的b<a |
| D、阴极的电极反应为HSO3--2e-+H2O═SO42-+3H+和SO32--2e-+2H2O═SO42-+4H+ |
考点:电解原理
专题:电化学专题
分析:A.根据电解质溶液中阴阳离子的移动方向确定电源的正负极;
B.阳极上亚硫酸根离子被氧化生成硫酸根离子,溶液酸性增强;
C.根据S原子守恒判断a、b大小;
D.电解池阴极上氢离子得电子发生还原反应.
B.阳极上亚硫酸根离子被氧化生成硫酸根离子,溶液酸性增强;
C.根据S原子守恒判断a、b大小;
D.电解池阴极上氢离子得电子发生还原反应.
解答:
解:A.根据阴阳离子的移动方向知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A错误;
B.阳极上,亚硫酸根离子被氧化生成硫酸根离子,亚硫酸是弱电解质,硫酸是强电解质,所以阳极附近氢离子浓度增大,溶液的pH减小,故B正确;
C.阳极室中,出来的硫酸中不仅有加入的稀硫酸还有亚硫酸根离子被氧化生成的硫酸,所以b>a,故C错误;
D.该电解池中阴极上生成氢气,应该是氢离子得电子发生还原反应,故D错误;
故选B.
B.阳极上,亚硫酸根离子被氧化生成硫酸根离子,亚硫酸是弱电解质,硫酸是强电解质,所以阳极附近氢离子浓度增大,溶液的pH减小,故B正确;
C.阳极室中,出来的硫酸中不仅有加入的稀硫酸还有亚硫酸根离子被氧化生成的硫酸,所以b>a,故C错误;
D.该电解池中阴极上生成氢气,应该是氢离子得电子发生还原反应,故D错误;
故选B.
点评:本题考查学生电解池的工作原理,能正确分析图片是解本题的关键,注意图片中加入物质和析出物质的变化.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
等质量的铁屑和锌粒与足量的同浓度的稀硫酸反应,下列图象可能正确的是( )
A、 |
B、 |
C、 |
D、 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍.下列说法不正确的是( )
| A、元素Z、W的简单离子的电子层结构相同 |
| B、元素Y的简单气态氢化物的热稳定性比Z的弱 |
| C、由X、Y、Z三种元素形成化合物,其水溶液可能显碱性 |
| D、W、Z两种元素形成的化合物中肯定不含共价键 |
下列图示实验现象及其解释不正确的是( )
A、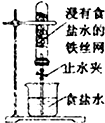 一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
B、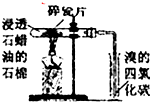 加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
C、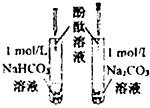 溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
D、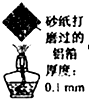 加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下,0.56L丙烷中含有共价键的数目为0.2NA |
| B、常温常压下,6.4g氧气和臭氧中含有的分子总数为0.2NA |
| C、1mol羟基中电子数为10NA |
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
下列表示对应化学反应的离子方程式正确的是( )
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是: