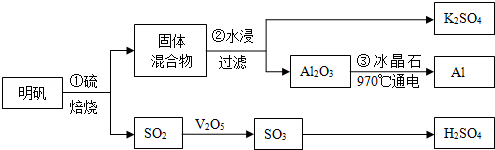
题目内容
2.用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和FeCl3溶液,可制得红褐色的氢氧化铁胶体.下列有关胶体的说法不正确的是( )| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
分析 A、胶体有吸附作用;
B、胶体的胶粒介于1nm-100nm之间;
C、丁达尔效应是胶体的特有性质;
D、渗析的方法可以除去胶体中的溶液.
解答 解:A、胶体有吸附作用,可以吸附水中的杂质,故可以净水,故A正确;
B、胶体的胶粒介于1nm-100nm之间,即直径大小 是10-9m-10-7m之间,故B错误;
C、丁达尔效应是胶体的特有性质,溶液和浊液均无,故可以用丁达尔效应来鉴别胶体和水,故C正确;
D、渗析的方法可以除去胶体中的溶液,故当氢氧化铁胶体中含氯化铁溶液时,可以用渗析的方法除去,故D正确.
故选B.
点评 本题考查了胶体的本质特征和胶体的性质,应注意的是胶体的特有性质是丁达尔效应,而本质特征是胶粒介于1nm-100nm之间.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
12.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
13.下列关于著名科学家的国籍、名字和研究成果的对应关系中,正确的是( )
| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 俄国门捷列夫---发现元素周期律 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |
10.下列反应的能量变化与其他三项不相同的是( )
| A. | 甲烷燃烧 | B. | 碳酸钙高温分解 | ||
| C. | 锌片与稀硫酸反应 | D. | 钠与冷水反应 |
17.下列说法正确的是( )
| A. | 标准状况下,单位物质的量的气体所占的体积就叫气体的摩尔体积 | |
| B. | 物质的量是表示一定数目粒子集合体的一个物理量 | |
| C. | 0.012kg的碳中所含的碳原子数就是阿伏伽德罗常数 | |
| D. | Al原子的摩尔质量为27g,Al3+因少了3个电子,摩尔质量更小 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
14.在某无色透明的强碱性溶液中,能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
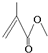 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.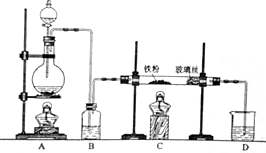 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题: