题目内容
14.在某无色透明的强碱性溶液中,能大量共存的离子组是( )| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
分析 强碱性溶液含大量的氢氧根离子离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.碱性条件下HCO3-不能大量共存,故A错误;
B.Cu2+为蓝色,与无色溶液不符,且碱性条件下不能大量共存,故B错误;
C.该组离子之间不反应,可大量共存,且离子均为无色,故C正确;
D.碱性条件下NH4+不能大量共存,故D错误.
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
4.在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,则下列事实或叙述能说明一元酸HA是弱酸的是( )
| A. | 两烧杯中参加反应的锌粒等量 | |
| B. | 反应开始时产生H2的速率相等 | |
| C. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大 | |
| D. | 甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大 |
5.下列说法正确的是( )
| A. | 标准状况下,氯气的摩尔体积为22.4L•mol-1 | |
| B. | 将标准状况下11.2L的HCl溶于1.0L的水中,所得溶液中HC1的浓度为O.5mol/L | |
| C. | 常温常压下,等体积的CO和H2的质量比为1:1 | |
| D. | 物质的摩尔质量在数值上等于其相对分子质量或相对原子质量 |
2.用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和FeCl3溶液,可制得红褐色的氢氧化铁胶体.下列有关胶体的说法不正确的是( )
| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
9.下列说法正确的是( )
| A. | 氧化还原反应一定属于四大基本反应类型 | |
| B. | 氧化还原反应中,反应物不是氧化剂就是还原剂 | |
| C. | 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质 | |
| D. | 失电子越多,还原性越强,得电子越多,氧化性越强 |
4.25℃,101k Pa时,强酸与强/碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |
11.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.1mol•L-1的盐酸进行滴定,完成下列问题:
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
请选用其中合理数据列出氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=0.1044mol/L.
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
8.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
②已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.25kJ•mol-1.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前3s内的平均反应速率v (N2)=1.42×10-4mol•L-1•s-1.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
③该可逆反应△S<0(填“>”、“<”或“=”),在低温(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是B

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
②已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.25kJ•mol-1.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v (N2)=1.42×10-4mol•L-1•s-1.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
③该可逆反应△S<0(填“>”、“<”或“=”),在低温(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是B

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
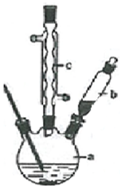 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: