题目内容
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,80 g SO3所占的体积约为22.4 L | |
| B. | 常温常压下,1.6 gO2和O3混合气体中质子总数为0.8NA | |
| C. | 0.1 mol甲基(-CH3)所含电子数为NA | |
| D. | 在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
分析 A、标况下三氧化硫为固体;
B、氧气和臭氧均由氧原子构成,而氧原子中含8个质子;
C、甲基中含9个电子;
D、硫酸氢钠在熔融状态下只能电离为钠离子和硫酸氢根离子.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、氧气和臭氧均由氧原子构成,故1.6g混合物中含氧原子0.1mol,而氧原子中含8个质子,故0.1mol氧原子中含0.8NA个质子,故B正确;
C、甲基中含9个电子,故0.1mol甲基中含0.9NA个电子,故C错误;
D、硫酸氢钠在熔融状态下只能电离为钠离子和硫酸氢根离子,故1mol硫酸氢钠在熔融状态下含1NA个阳离子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
17.以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
18.下列说法中正确的是( )
| A. | 在标准状况下,22.4L水的质量约为18g | |
| B. | 22.4LN2含6.02×1023个氮气分子 | |
| C. | 2gH2占有的体积约为22.4L | |
| D. | 22g二氧化碳与标准状况下11.2LHCl气体含有相同的分子数 |
15.下列实验设计能完成或实验结论合理的( )
| 操作及现象 | 结 论 | |
| A | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| B | 向硅酸钠溶液中,滴入硫酸 | 可以验证S的氧化性强于Si |
| C | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| D | 向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| A. | A | B. | B | C. | C | D. | D |
2.用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和FeCl3溶液,可制得红褐色的氢氧化铁胶体.下列有关胶体的说法不正确的是( )
| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
12.已知某温度下,四种一元弱酸的电离平衡常数为:物质的量浓度都为0.1mol•L-1的下列溶液中,pH最小的是( )
| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
4.25℃,101k Pa时,强酸与强/碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3kJ/mol;辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |
1.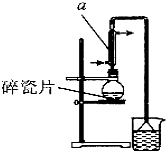 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:
NaBr+H2SO4$\frac{\underline{\;微热\;}}{\;}$HBr+NaHSO4①
C4H9-OH+HBr$\stackrel{△}{→}$C4H9-Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.
有关数据列表如下:
(1)实验装置中仪器a的名称是直形冷凝管;反应加热时的温度不宜超过100℃,较好的加热方法是水浴加热.圆底烧瓶中碎瓷片的作用是防止暴沸;.装置中倒扣漏斗的作用是防止溴化氢极易溶于水而倒吸;
(2)制备操作中,加入的浓硫酸必须进行适当稀释,其目的是abc(填字母序号).
a.减少副产物烯和醚的生成
b.减少 Br2的生成
c.减少 HBr 的挥发
d.水是反应的催化剂
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应采取蒸馏操作得到较纯的1-溴丁烷,蒸馏装置除了用到冷凝管、温度计、牛角管、锥形瓶,还需要的玻璃仪器是酒精灯、蒸馏烧瓶;
(4)将反应结束后得到的混合物经过蒸馏操作得到较纯的1-溴丁烷的产物中,可能含有的杂质主要是水;
(5)将1-溴丁烷产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(6)某实验小组制取1-溴丁烷时,向圆底烧瓶中加入7.4g正丁醇,13.0g NaBr和足量的浓硫酸,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2 位有效数字).
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:NaBr+H2SO4$\frac{\underline{\;微热\;}}{\;}$HBr+NaHSO4①
C4H9-OH+HBr$\stackrel{△}{→}$C4H9-Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.
有关数据列表如下:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
(2)制备操作中,加入的浓硫酸必须进行适当稀释,其目的是abc(填字母序号).
a.减少副产物烯和醚的生成
b.减少 Br2的生成
c.减少 HBr 的挥发
d.水是反应的催化剂
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应采取蒸馏操作得到较纯的1-溴丁烷,蒸馏装置除了用到冷凝管、温度计、牛角管、锥形瓶,还需要的玻璃仪器是酒精灯、蒸馏烧瓶;
(4)将反应结束后得到的混合物经过蒸馏操作得到较纯的1-溴丁烷的产物中,可能含有的杂质主要是水;
(5)将1-溴丁烷产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(6)某实验小组制取1-溴丁烷时,向圆底烧瓶中加入7.4g正丁醇,13.0g NaBr和足量的浓硫酸,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2 位有效数字).
 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.