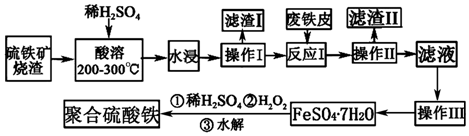
题目内容
12.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
分析 A.溶液体积不知不能计算微粒数;
B.标准状况下四氯化碳不是气体;
C.铁和盐酸反应生成氯化亚铁,铁和氯气反应生成氯化铁;
D.1mol钠完全反应失电子1mol.
解答 解:A.1mol/L Na2CO3溶液体积不知不能计算微粒数,故A错误;
B.标准状况下四氯化碳不是气体,标准状况下,11.2L CCl4所含物质的量不是0.5mol,则分子数不为0.5NA,故B错误;
C.5.6g铁的物质的量为0.1mol,铁与盐酸反应后变为+2价,转移0.2mol电子,铁与氯气反应后变为+3价,转移0.3mol电子,故C错误;
D.1mol钠完全反应失电子1mol,生成Na2O和Na2O2的混合物,转移电子总数NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件的应用分析,氧化还原反应电子转移的计算判断、掌握基础是关键,题目较简单.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
2.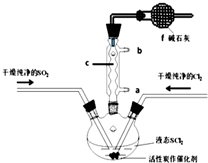 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
(1)装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,但使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(4)下列四种制备SO2的方案中最佳选择是丁
(5)试验结束后,将三颈烧瓶中液体混合物分离开的实验操作是蒸馏(填操作名称,已知SCl2的沸点为50℃).若反应中消耗的Cl2的体积为896ml(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为50%
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:(1)装置f的作用是吸收逸出有毒的Cl2、SO2,防止空气中的水蒸气进入反应装置,防止SOCl2水解.
(2)实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑.蒸干AlCl3溶液不能得到无水AlCl3,但使SOCl2与AlCl3•6H2O混合加热,可得到无水AlCl3,试解释原因:AlCl3溶液易水解,AlCl3•6H2O与SOCl2混合加热,SOCl2与AlCl3•6H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl抑制AlCl3水解;
(4)下列四种制备SO2的方案中最佳选择是丁
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 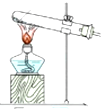 |  | 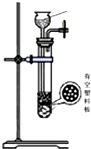 | 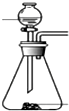 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静止得到无色溶液w,检验溶液w中存在的Cl-的方法是取少量无色溶液放入试管中,加入Ba(NO3)2溶液至不再生沉淀为止,静置,取出上层清液,加入AgNO3溶液,有白色沉淀生成,可知无色溶液中含有Cl-.
3. 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液.需要的仪器有烧杯、胶头滴管、玻璃棒、托盘天平、药匙、250mL容量瓶.(填仪器)
(2)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中(填仪器),加酚酞溶液,用0.2000mol/L的盐酸溶液滴定.
(3)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:0.4000 mol•L-1(准确到小数点后四位).
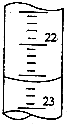
(4)如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液.需要的仪器有烧杯、胶头滴管、玻璃棒、托盘天平、药匙、250mL容量瓶.(填仪器)
(2)取10.00mL待测液,用碱式滴定管量取注入锥形瓶中(填仪器),加酚酞溶液,用0.2000mol/L的盐酸溶液滴定.
(3)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:0.4000 mol•L-1(准确到小数点后四位).
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
7.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{c^2(N{O}_{2})}{c^2(NO)•c({O}_{2})}$;若其他条件不变,容器体积缩小为1L,则K值不变.(增大、减小或不变);若K300°C>K350°C,则该反应是放热反应.
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
| 时间(s) | 0 | 1 | 2 | 3 | 4 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1;
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
17.以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
4.在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,则下列事实或叙述能说明一元酸HA是弱酸的是( )
| A. | 两烧杯中参加反应的锌粒等量 | |
| B. | 反应开始时产生H2的速率相等 | |
| C. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大 | |
| D. | 甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大 |
1.下列物质属于强电解质的是( )
| A. | Fe(OH)3 | B. | FeCl3 | C. | Al(OH)3 | D. | Fe(OH)2 |
2.用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和FeCl3溶液,可制得红褐色的氢氧化铁胶体.下列有关胶体的说法不正确的是( )
| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |