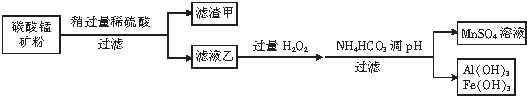
题目内容
16.(1)某有机物的结构按键线式如图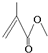 ,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.
,它的分子式为C5H8O2,存在的官能团有碳碳双键和酯基,该物质能发生的反应类型有加成反应、氧化反应、水解反应.(2)从下列物质中选择合适的物质制备乙醇,至少写出三种方法CH2=CH2+H2O$\stackrel{一定条件}{→}$C2H5OH; C2H5Br+NaOH$\stackrel{△}{→}$C2H5OH+NaBr+H2O;CH3CHO+H2$→_{△}^{催化剂}$C2H5OH,CH3COOC2H5+H2O$?_{△}^{酸}$CH3COOH+CH3CH2OH.(用化学方程式表示)
备选物质有:乙烯,溴乙烷,乙醛,乙酸乙酯,氢气,溴水,NaOH水溶液,水.
分析 (1)根据键线式的特点以线示键,每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,C、H原子不表示出来,写化学式;常见的官能团有:碳碳双键、碳碳三键、羟基、羧基、酯基等;
(2)乙醇的分子式是:C2H6O,结构简式是:CH3CH2OH或C2H5OH、乙醇分子中官能团是羟基(-OH),制备乙醇需引入羟基,根据备选物质合成.
解答 解:(1)根据键线式的书写特点,图 ,每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,它的分子式为C5H8O2,官能团为碳碳双键和酯基,
,每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,它的分子式为C5H8O2,官能团为碳碳双键和酯基,
故答案为:C5H8O2;碳碳双键和酯基;加成反应、氧化反应、水解反应;
(2)乙醇的分子式是:C2H6O,结构简式是:CH3CH2OH或C2H5OH、乙醇分子中官能团是羟基(-OH),制备乙醇需引入羟基,乙烯含有碳碳双键,可由双键的水化引入羟基,反应为:CH2=CH2+H2O$\stackrel{一定条件}{→}$C2H5OH,也可由卤代烃在碱性条件下的水解制取,反应为:C2H5Br+NaOH$\stackrel{△}{→}$C2H5OH+NaBr+H2O,醛基的氢化也能引入醇羟基,反应为:CH3CHO+H2$→_{△}^{催化剂}$C2H5OH,也可为酯的水解,乙酸乙酯在酸性条件下水解生成乙酸和乙醇,化学反应方程式为:CH3COOC2H5+H2O$?_{△}^{酸}$CH3COOH+CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$C2H5OH;C2H5Br+NaOH$\stackrel{△}{→}$C2H5OH+NaBr+H2O;CH3CHO+H2$→_{△}^{催化剂}$C2H5OH,CH3COOC2H5+H2O$?_{△}^{酸}$CH3COOH+CH3CH2OH.
点评 本题主要考查了键线式的特点、有机物的合成,抓住键线式特点即可写出其分子式.,明确常见的烃的衍生物的官能团类型及具有的化学性质是解答制备乙醇的关键,题目难度中等.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | Fe(OH)3 | B. | FeCl3 | C. | Al(OH)3 | D. | Fe(OH)2 |
| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |
(1)称取5.0g该氢氧化钠固体样品,配成500mL溶液备用;
(2)将标准盐酸装在酸式滴定管中,调节液面位置在“0”刻度以下,并记录下刻度;
(3)取25.00mL待测液.该项实验操作使用的主要仪器有(除锥形瓶外)碱式滴定管,用酚酞作指示剂时,滴定到溶液颜色由红色刚好变成无色为止;
(4)某同学根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是CD(填写编号)
A.中和滴定达终点时俯视滴定管内液面度数
B.碱式滴定管用蒸馏水洗净后立即取用25ml待测碱溶液注入锥形瓶进行滴定
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定.
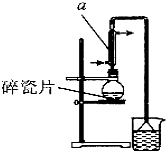 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备 1-溴丁烷的反应和实验装置如下:NaBr+H2SO4$\frac{\underline{\;微热\;}}{\;}$HBr+NaHSO4①
C4H9-OH+HBr$\stackrel{△}{→}$C4H9-Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.
有关数据列表如下:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
(2)制备操作中,加入的浓硫酸必须进行适当稀释,其目的是abc(填字母序号).
a.减少副产物烯和醚的生成
b.减少 Br2的生成
c.减少 HBr 的挥发
d.水是反应的催化剂
(3)反应结束后,将反应混合物中1-溴丁烷分离出来,应采取蒸馏操作得到较纯的1-溴丁烷,蒸馏装置除了用到冷凝管、温度计、牛角管、锥形瓶,还需要的玻璃仪器是酒精灯、蒸馏烧瓶;
(4)将反应结束后得到的混合物经过蒸馏操作得到较纯的1-溴丁烷的产物中,可能含有的杂质主要是水;
(5)将1-溴丁烷产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(6)某实验小组制取1-溴丁烷时,向圆底烧瓶中加入7.4g正丁醇,13.0g NaBr和足量的浓硫酸,最终制得1-溴丁烷9.6g,则1-溴丁烷的产率是70%(保留2 位有效数字).
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
②已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.25kJ•mol-1.
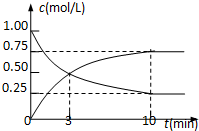
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v (N2)=1.42×10-4mol•L-1•s-1.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
③该可逆反应△S<0(填“>”、“<”或“=”),在低温(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是B

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.