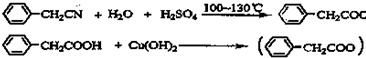题目内容
17.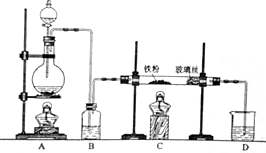 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:(1)用如图所示的装置向500-600℃的铁屑中通入氯气制取无水氯化铁的实验中,实验开始前应如何检查装置的气密性.
(2)用如图所示的装置向炽热铁屑中通入氯化氢制取无水氯化亚铁的实验中,装置A用来制取.若仍用D的装置进行尾气处理,存在的问题是易发生倒吸,缺少防止水蒸汽进入C中装置、通入氯化氢(赶尽装置中的空气).
若操作不当,制得的FeCl2会含有少量FeCl3.欲制得纯净的FeCl2,在实验操作中应先,再点燃C处的酒精灯.
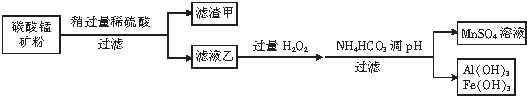
(3)从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程如下.
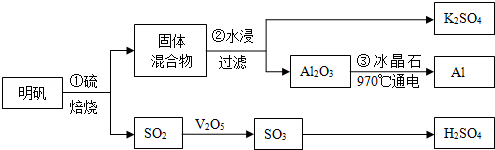
①反应①的化学方程式是4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O.
②从水浸后的滤液中得到K2SO4晶体的方法是蒸发、结晶.步骤③的化学方程式是2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑;.
③焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为$\frac{216a}{b}$吨(列出计算表达式).
分析 (1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)制取无水氯化亚铁,需要HCl气体,尾气的成分是剩余HCl和生成的氢气,HCl极易溶解于水,缺少防止水蒸汽进入C中装置,氢气不能溶于水;若要制取纯净的FeCl2,需先点燃A处的酒精灯排除装置中的空气,再点燃C处的酒精灯;
(3)从明矾[KAl(SO4)2•12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al.
①“焙烧”过程中得到SO2与固体混合物,而固体混合物进行水浸,过滤得到Al2O3与K2SO4,则焙烧”过程中得到SO2、Al2O3、K2SO4,同时有水生成,配平是化学方程式;
②从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作;步骤③为氧化铝电解生成铝和氧气;
③将SO2的利用率转化为KAl(SO4)2•12H2O的利用率,由焙烧”过程中反应方程式,及硫元素守恒,可得关系式:4KAl(SO4)2•12H2O~9H2SO4,据此计算.
解答 解:(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,改变体系内压强,生成气泡或形成水柱是常用的方法,所以图1装置,检查装置的气密性,把B、D中导管下端浸入水中,用洒精灯给烧瓶微热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气,
故答案为:把B、D中导管下端浸入水中,用洒精灯给烧瓶微热,看到B、D中导管下口有气泡冒出,停止加热后,有一段稳定的水柱,说明装置不漏气;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;加热\;}}{\;}$FeCl2+H2,故尾气的成分为未反应的HCl和生成的氢气,由于HCl极易溶于水,故若仍然采用D装置进行尾气处理,很容易造成倒吸,且缺少防止水蒸汽进入C中装置,氢气不溶于水,不利于氢气的吸收,氢气易燃,造成安全隐患,若要制取纯净的FeCl2,需先排净装置中的空气,防止在加热时Fe与O2反应,故先点燃A处的酒精灯,再点燃C处的酒精灯,
故答案为:HCl; 易发生倒吸,缺少防止水蒸汽进入C中装置; 通入氯化氢(赶尽装置中的空气);
(3)①“焙烧”过程中得到SO2与固体混合物,而固体混合物进行水浸,过滤得到Al2O3与K2SO4,则焙烧”过程中得到SO2、Al2O3、K2SO4,同时有水生成,发生反应为:4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+2K2SO4+9SO2↑+48H2O,
故答案为:4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2K2SO4+2Al2O3+9SO2↑+48H2O;
②从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,步骤③为电解氧化铝,氧化铝熔点高,用冰晶石作助熔剂,电解氧化铝生成铝和氧气,反应为:2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑,
故答案为:蒸发、结晶;2Al2O3$\frac{\underline{\;\;\;\;\;冰晶石\;\;\;\;\;}}{970℃电解}$4Al+3O2↑;
③设可生产x吨质量分数为98%的硫酸,则:
4KAl(SO4)2•12H2O~9H2SO4,
4×b 9×98
at×96% xt×98% 解得:x=$\frac{216a}{b}$,
故答案为:$\frac{216a}{b}$.
点评 本题以氯化铁以及氯化亚铁、Al、K2SO4和H2SO4制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案| A. | 氢氧化铁胶体具有吸附性,可做净水剂 | |
| B. | 该胶体的分散系的分散质粒子的直径大小 是10-9nm-10-7nm之间 | |
| C. | 可用丁达尔效应鉴别氢氧化铁胶体和水 | |
| D. | 可用渗析的方法分离FeCl3溶液和Fe(OH)3胶体 |
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.
②已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.25kJ•mol-1.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)×(10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)×(10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前3s内的平均反应速率v (N2)=1.42×10-4mol•L-1•s-1.
②在该温度下,反应的平衡常数K=5000.(只写出计算结果)
③该可逆反应△S<0(填“>”、“<”或“=”),在低温(填“高温”、“低温”或“任何温度”)下能自发进行.
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是B

A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.

(1)已知步骤①反应器发生的反应为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,
该反应的还原产物为KCl、Cl2;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是降温结晶.
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
(3)①已知:
测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.00×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.则加碘食盐样品中的碘元素含量是$\frac{1270}{3w}$mg•kg-1(以含w的代数式表示).
②学生乙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL0.1mol•L-1KI溶液,振荡 | 溶液无变化 |
| 然后再滴入1mol•L-1的H2SO4,充分振荡 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:偏大,过量的I-会被空气中的O2氧化为I2 .
(4)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①根据上述实验现象,加碘盐中可能含有的物质中不能确定的是Mg2+.
②第二份试液中加入足量KI固体后,反应的离子方程式为2Fe3++2I-=2Fe2++I2、IO3-+5I-+6H+═3I2+3H2O.
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol. CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.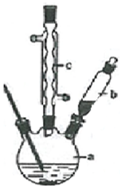 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: