题目内容
20.将标准状况下2.24L CO2缓慢通入100mL1.5mol•L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是( )| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
分析 标准状况下2.24L CO2的物质的量为n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.1L×1.5mol/L=0.15mol,则发生反应为:2CO2+3OH-═CO32-+HCO3-+H2O,结合CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-及溶液的电中性原则、物料守恒以及质子守恒解答该题.
解答 解:n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.1L×1.5mol/L=0.15mol,则发生:2CO2+3OH-═CO32-+HCO3-+H2O,则溶液中的溶质是等物质的量的碳酸钠和碳酸氢钠,
A.HCO3-水解程度大于其电离程度,CO32-的水解程度大于HCO3-的水解程度,故c(HCO3-)略大于c(CO32-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-),故A错误;
B.根据电荷守恒得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B正确;
C.碳酸氢钠和碳酸钠溶液都呈碱性,则c(H+)<c(OH-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故C错误;
D.根据物料守恒得:c(HCO3-)+c(CO32-)+c(H2CO3)=1mol•L-1,故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确反应后溶质组成为解本题关键,结合电荷守恒和物料守恒及盐的水解原理分析,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
11.下列有关硝酸化学性质的叙述中,正确的是( )
| A. | 浓、稀硝酸都能使蓝色石蕊试纸最终变为红色 | |
| B. | 硝酸能与Cu反应,只表现氧化性 | |
| C. | 硝酸可与Na2S反应制得H2S气体 | |
| D. | 浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色 |
8.页岩气是蕴藏于页岩层中的天然气,我州页岩气蕴藏量达4.81万亿立方米,约占全省近7成,可采储量超过1.443万亿立方米.页岩气将是我州能源开发的重要方向.下列有关结论中错误的是( )
| A. | 页岩气是一种清洁的能源 | |
| B. | 使用页岩气是对化学能的充分利用 | |
| C. | 使用页岩气给农民的生活带来了不便 | |
| D. | 页岩气是我州解决能源的重要途径 |
15.随着手机、手提电脑、数码相机等电器的普及,锂电池的生产量和消费量大.造成资源短缺,钴的毒性又很大.因此,回收锂电池既有较大的经济价值,又有益于保护生态环境.某课题小组提出如下方案对某钴酸锂正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)进行回收钴等金属.
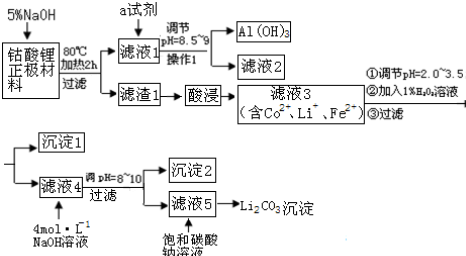
已知:金属氢氧化物沉淀的pH值
回答下列问题:
(1)写出钴酸锂正极材料用加5%氢氧化钠溶液,发生的离子反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)操作1所用到的玻璃仪器除烧杯、漏斗外,还必须有玻璃棒(填仪器名称).
(3)滤液4到沉淀2可以选择抽滤,抽滤不仅能加快过滤速度,而且能得到比较干燥的晶体.但是,太细的晶体不适合于抽滤.一般情况下,下列哪些因素有利于得到较大的晶体AC.(填写序号)
A.缓慢冷却溶液B.溶质溶解度较小
C.缓慢蒸发溶剂 D.溶液浓度较高
(4)该课题组同学将滤渣1酸浸溶解得到Co2+用盐酸进行溶解.发生如下反应:
2LiCoO2+8HCl═2CoCl2+Cl2+2LiCl+4H2O
在此反应中,体现了盐酸的酸性和还原性.
指导老师建议采用稀硫酸和H2O2溶液溶解,发生如下反应:
2LiCoO2+□+6H++1H2O2=2Co2++1O2↑+2Li++4□
在上述方程式的□中填上缺少的微粒,并进行配平.
你认为指导老师提出该建议的主要依据是用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦
(5)试剂a最好选用下列试剂中的C
A.NaOH溶液 B.(NH4)2CO3溶液 C.NH4HCO3
(6)沉淀2的化学式是Co(OH)2.

已知:金属氢氧化物沉淀的pH值
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
(1)写出钴酸锂正极材料用加5%氢氧化钠溶液,发生的离子反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)操作1所用到的玻璃仪器除烧杯、漏斗外,还必须有玻璃棒(填仪器名称).
(3)滤液4到沉淀2可以选择抽滤,抽滤不仅能加快过滤速度,而且能得到比较干燥的晶体.但是,太细的晶体不适合于抽滤.一般情况下,下列哪些因素有利于得到较大的晶体AC.(填写序号)
A.缓慢冷却溶液B.溶质溶解度较小
C.缓慢蒸发溶剂 D.溶液浓度较高
(4)该课题组同学将滤渣1酸浸溶解得到Co2+用盐酸进行溶解.发生如下反应:
2LiCoO2+8HCl═2CoCl2+Cl2+2LiCl+4H2O
在此反应中,体现了盐酸的酸性和还原性.
指导老师建议采用稀硫酸和H2O2溶液溶解,发生如下反应:
2LiCoO2+□+6H++1H2O2=2Co2++1O2↑+2Li++4□
在上述方程式的□中填上缺少的微粒,并进行配平.
你认为指导老师提出该建议的主要依据是用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦
(5)试剂a最好选用下列试剂中的C
A.NaOH溶液 B.(NH4)2CO3溶液 C.NH4HCO3
(6)沉淀2的化学式是Co(OH)2.
5.在NaBr和NaI的混合物溶液中通入过量的Cl2把溶液蒸干后并将剩余物灼烧,最后剩余物质是( )
| A. | NaCl、Br2、I2 | B. | NaCl | C. | NaCl、Br2 | D. | NaCl、I2 |
12.同温同压下,将一定量的硫化氢和二氧化硫混合后恰好完全反应,若反应中转移的电子是1mol,则在反应中生成的硫为( )
| A. | 1 mol | B. | 0.75 mol | C. | 0.5 mol | D. | 0.25 mol |
9.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和$\frac{1}{2}$O2+H2O+2e-═2OH-则下列叙述正确的是( )
| A. | 通H2的极是正极,通入O2的极是负极 | |
| B. | 通O2的极是正极,通入H2的极是负极 | |
| C. | 工作一段时间后电解质溶液碱性增强 | |
| D. | 工作时负极区附近碱性不变 |
10.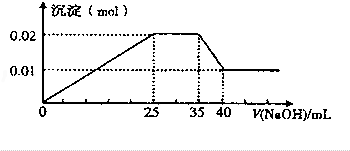 现有一无色溶液含有以下离子(忽略由水电离产生的H+、OH-):NH4+、Mg2+、Al3+、NO3-,取100mL该溶液并逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示,则NO3-的物质的量是( )
现有一无色溶液含有以下离子(忽略由水电离产生的H+、OH-):NH4+、Mg2+、Al3+、NO3-,取100mL该溶液并逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示,则NO3-的物质的量是( )
 现有一无色溶液含有以下离子(忽略由水电离产生的H+、OH-):NH4+、Mg2+、Al3+、NO3-,取100mL该溶液并逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示,则NO3-的物质的量是( )
现有一无色溶液含有以下离子(忽略由水电离产生的H+、OH-):NH4+、Mg2+、Al3+、NO3-,取100mL该溶液并逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示,则NO3-的物质的量是( )| A. | 0.08mol | B. | 0.07mol | C. | 0.06mol | D. | 0.05mol |