题目内容
10.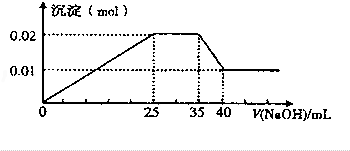 现有一无色溶液含有以下离子(忽略由水电离产生的H+、OH-):NH4+、Mg2+、Al3+、NO3-,取100mL该溶液并逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示,则NO3-的物质的量是( )
现有一无色溶液含有以下离子(忽略由水电离产生的H+、OH-):NH4+、Mg2+、Al3+、NO3-,取100mL该溶液并逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图所示,则NO3-的物质的量是( )| A. | 0.08mol | B. | 0.07mol | C. | 0.06mol | D. | 0.05mol |
分析 无色溶液逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液有沉淀生成,说明一定不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,由此结合溶液中的电荷守恒分析解答.
解答 解:由图可知,开始加入氢氧化钠溶液有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,说明含有铵根离子,最后沉淀不能完全溶液,说明溶液中含Mg2+,由则生成的0.01mol沉淀为Mg(OH)2,n(Mg(OH)2)=0.01mol,铝离子和NaOH溶液反应生成Al(OH)3沉淀为0.01mol,即n(Al3+)=0.01mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=$\frac{0.02mol}{0.01L}$=2.00mol/L,铵根离子消耗10mL的氢氧化钠,根据NH4++OH-=NH3•H2O,得到:n(NH4+)=2.00mol/L×0.01L=0.02mol,根据电荷守恒,硝酸根离子物质的量n=0.02mol+0.01mol×3+0.01mol×2=0.07mol,
故选B.
点评 本题考查了离子共存、离子反应的计算等知识点,定性分析离子共存、定量分析离子的物质的量是解本题的关键,题目难度中等.

| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
①CaCl2溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液.
| A. | ①②③④ | B. | 只有②④ | C. | 只有①②③ | D. | 只有④ |
| A. | :He | B. |  | C. | 1s2 | D. |  |
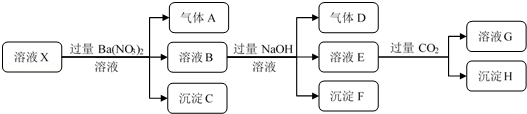
| A. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ | |
| B. | 沉淀H为Al(OH)3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.15 mol•L |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是Ar;
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,
(3)形成化合物种类最多的元素是C;
(4)它们的氢化物分子间存在氢键的氢化物分子式是NH3、H2O
(5)在这些元素中,最活泼的金属在空气中加热反应的产物溶于水时反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑.
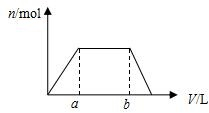 将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )
将足量CO2通入100mLKOH和Ca(OH)2的混合溶液中,生成沉淀的物质的量(n)和通入标况下CO2体积(V)的关系如图所示,则混合溶液中KOH的物质的量浓度为( )| A. | 10(b-a)/22.4 mol/L | B. | 20(b-a)/22.4 mol/L | ||
| C. | 10b/22.4 mol/L | D. | 10a/22.4 mol/L |
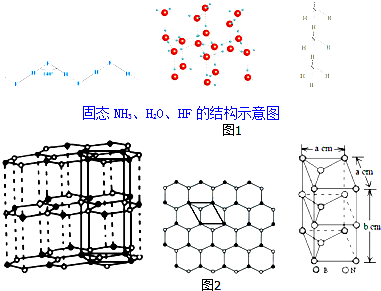
(1)基态Cu2+的电子排布式为1s22s22p63s23p63d9,其最外电子层的电子数为17.
(2)利用价层电子对互斥理论(VSEPR theory)预测多原子分子或离子立体构型时,认为价层电子间互斥力(F)的大小决定了夹角(∠)的大小:F(孤电子对间)>F(孤电子对-双键电子)>F(双键电子-单键电子)>F(单键电子间),则a.∠(孤-孤夹角)、b.∠(孤-双夹角)、c.∠(双-单夹角)、d.∠(单-单夹角)由大到小的排序为abcd(填编号);XeF4中Xe价层电子数为6对,画出其VSEPR模型(含中心原子的孤电子对)
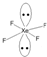 .
.(3)在图1中,除NH3、H2O、HF外的同主族氢化物的沸点随周期数增大而升高的原因是同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大;
已知固态NH3、H2O、HF的氢键键能和结构如表:
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
(4)石墨型BN呈白色,亦称“白石墨”,“白石墨”在一定条件下可转化为金刚石型BN.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”的密度为$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3(以含a、b的代数式表示).