题目内容
9.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和$\frac{1}{2}$O2+H2O+2e-═2OH-则下列叙述正确的是( )| A. | 通H2的极是正极,通入O2的极是负极 | |
| B. | 通O2的极是正极,通入H2的极是负极 | |
| C. | 工作一段时间后电解质溶液碱性增强 | |
| D. | 工作时负极区附近碱性不变 |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答 解:A、在燃料电池中,通入燃料氢气的一极为电池的负极,通入O2的一极是正极,故A错误;
B、在燃料电池中,通入燃料氢气的一极为电池的负极,通入O2的一极是正极,故B正确;
C、氢氧燃料电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,工作一段时间后电解质溶液的pH减小,故C错误;
D、氢氧燃料电池中通入氢气的一极为电池的负极,发生氧化反应,电极反应为:H2+2OH-=2H2O+2e-,负极区附近pH减小,故D错误.
故选B.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式的书写.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
20.将标准状况下2.24L CO2缓慢通入100mL1.5mol•L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
4.具有下列电子排布式的原子中,半径最大的是( )
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
14.某元素R的最外层电子数是次外层电子数的2倍,由此可以判断( )
| A. | R一定是第2周期元素 | |
| B. | R一定是VA族元素 | |
| C. | R的气态氢化物一定比同周期其他元素气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
1.将过量的CO2分别通入下列溶液中,最终有沉淀析出的溶液是( )
①CaCl2溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液.
①CaCl2溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④饱和Na2CO3溶液.
| A. | ①②③④ | B. | 只有②④ | C. | 只有①②③ | D. | 只有④ |
18.以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是( )
| A. | :He | B. |  | C. | 1s2 | D. |  |
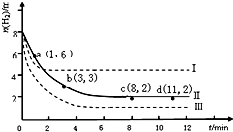
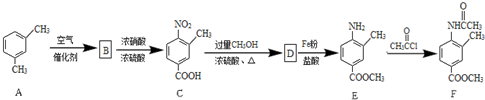
 .
. .
.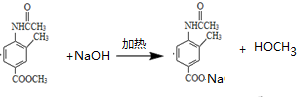 .
.