题目内容
15.随着手机、手提电脑、数码相机等电器的普及,锂电池的生产量和消费量大.造成资源短缺,钴的毒性又很大.因此,回收锂电池既有较大的经济价值,又有益于保护生态环境.某课题小组提出如下方案对某钴酸锂正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)进行回收钴等金属.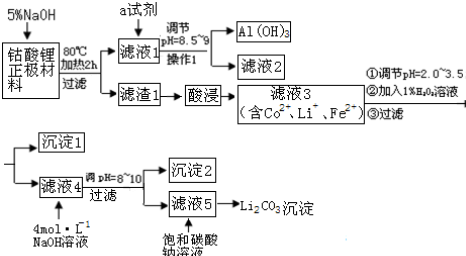
已知:金属氢氧化物沉淀的pH值
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
(1)写出钴酸锂正极材料用加5%氢氧化钠溶液,发生的离子反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)操作1所用到的玻璃仪器除烧杯、漏斗外,还必须有玻璃棒(填仪器名称).
(3)滤液4到沉淀2可以选择抽滤,抽滤不仅能加快过滤速度,而且能得到比较干燥的晶体.但是,太细的晶体不适合于抽滤.一般情况下,下列哪些因素有利于得到较大的晶体AC.(填写序号)
A.缓慢冷却溶液B.溶质溶解度较小
C.缓慢蒸发溶剂 D.溶液浓度较高
(4)该课题组同学将滤渣1酸浸溶解得到Co2+用盐酸进行溶解.发生如下反应:
2LiCoO2+8HCl═2CoCl2+Cl2+2LiCl+4H2O
在此反应中,体现了盐酸的酸性和还原性.
指导老师建议采用稀硫酸和H2O2溶液溶解,发生如下反应:
2LiCoO2+□+6H++1H2O2=2Co2++1O2↑+2Li++4□
在上述方程式的□中填上缺少的微粒,并进行配平.
你认为指导老师提出该建议的主要依据是用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦
(5)试剂a最好选用下列试剂中的C
A.NaOH溶液 B.(NH4)2CO3溶液 C.NH4HCO3
(6)沉淀2的化学式是Co(OH)2.
分析 废旧锂离子电池正极正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)用氢氧化钠溶液碱溶,铝箔参加反应,过滤得到滤液1偏铝酸钠溶液,调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入酸,过氧化氢调节溶液PH过滤得到滤液含二价钴离子和锂离子,沉淀1是氢氧化铁,向滤液4中加氢氧化钠调节PH得到沉淀2,沉淀2为氢氧化钴沉淀,滤液5中含锂离子,加入饱和碳酸钠溶液沉淀锂离子得到碳酸锂沉淀,
(1)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(2)操作1为过滤,根据过滤实验选择;
(3)晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液浓度越高,或溶剂的蒸发速度越快,或溶液冷却越快,析出的晶粒就越小;
(4)盐酸在反应中的化合价升高,失电子作还原剂,在产物中生成了氯化物,体现了盐酸的酸性;根据所加入的反应物以及生成物结合守恒定律来书写化学方程式;根据环境保护和操作的便利性提出建议;
(5)偏铝酸根与碳酸氢根反应产生氢氧化铝;
(6)根据分析可知沉淀2是氢氧化钴.
解答 解:废旧锂离子电池正极正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)用氢氧化钠溶液碱溶,铝箔参加反应,过滤得到滤液1偏铝酸钠溶液,调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入酸,过氧化氢调节溶液PH过滤得到滤液含二价钴离子和锂离子,沉淀1是氢氧化铁,向滤液4中加氢氧化钠调节PH得到沉淀2,沉淀2为氢氧化钴沉淀,滤液5中含锂离子,加入饱和碳酸钠溶液沉淀锂离子得到碳酸锂沉淀.
(1)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)操作1为过滤,所用到的玻璃仪器除烧杯、漏斗外,还需要玻璃棒,
故答案为:玻璃棒;
(3)晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液浓度越高,或溶剂的蒸发速度越快,或溶液冷却越快,析出的晶粒就越小;反之,可得到较大的晶体颗粒,故答案为:AC;
(4)盐酸在反应中的化合价升高,失电子作还原剂,盐酸体现了还原性,在产物中生成了氯化物,体现了盐酸的酸性;钴的化合价从+3降到+2,双氧水中的氧从-1升高到0,1个双氧水升高2价,则LiCoO2与H2O2之比为2:1,配平离子方程式为:2LiCoO2+6H++H2O2=2 Co2++O2↑+2Li++4H2O;根据环境保护和操作的便利性提出建议为:用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦,
故答案为:酸性和还原性;2;6H+;1;2;1;2;4H2O;用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦;
(5)滤液1偏铝酸钠溶液,偏铝酸根与碳酸氢根反应产生氢氧化铝,所以选碳酸氢钠,
故答案为:C;
(6)向滤液4中加氢氧化钠调节PH为8到10,二价钴离子全部沉淀,则沉淀2为氢氧化钴,
故答案为:Co(OH)2.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. |  | B. |  | C. |  | D. |  |
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190 | -70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ②③④ |
| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
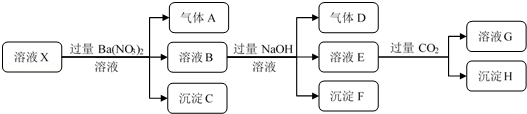
| A. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ | |
| B. | 沉淀H为Al(OH)3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.15 mol•L |
 ,加聚反应.
,加聚反应.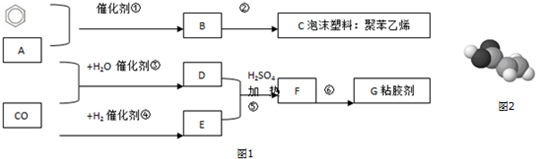

 .
.