题目内容
在硫酸铝、硫酸钾和明矾的混合溶液中,如果c(SO42-=0.2mol/L,当加等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的浓度是( )
| A、0.2 mol/L |
| B、0.25 mol/L |
| C、0.45 mol/L |
| D、0.225 mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:硫酸铝、硫酸钾和明矾的混合溶液中只含有SO42-、Al3+、K+.加入等体积KOH溶液时,生成的沉淀恰好完全溶解,发生总反应为:Al3++4OH-=AlO2-+2H2O,根据方程式可知,原溶液中c(Al3+)=
c(OH-),根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42),据此计算原溶液中K+离子的浓度.
| 1 |
| 4 |
解答:
解:硫酸铝、硫酸钾和明矾的混合溶液中只含有SO42-、Al3+、K+.加入等体积KOH溶液时,生成的沉淀恰好完全溶解,发生总反应Al3++4OH-=AlO2-+2H2O,根据方程式可知,n(Al3+)=
n(OH-),所以原溶液中c(Al3+)=
c(OH-)=
×0.2mol/L=0.05mol/L,根据溶液呈电中性可知,原混合溶液中3c(Al3+)+c(K+)=2c(SO42-),所以c(K+)=2c(SO42-)-3c(Al3+)=2×0.2mol/L-3×0.05mol/L=0.25mol/L.
故选:B.
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
故选:B.
点评:本题考查离子方程式的计算,难度中等,清楚反应过程判断原溶液中铝离子的浓度与氢氧化钠溶液的浓度关系是关键,注意电荷守恒应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、常温常压下,32gO2和O3的混合气体所含原子数为2NA |
| B、1.8g重水(D2O)中含NA个中子 |
| C、标准状况下11.2L乙醇中含0.5NA个乙醇分子 |
| D、8gCuSO4 溶于水中配成0.1mol/L的溶液500ml |
下列各反应,能用同一离子方程式表示的是( )
| A、氢氧化铜与盐酸、氢氧化铜与醋酸 |
| B、氯化钡溶液与硫酸铜溶液、氢氧化钡溶液与硫酸铜溶液 |
| C、氢氧化钡与稀硫酸、氢氧化钡与稀盐酸 |
| D、石灰石与稀硝酸、石灰石与稀盐酸 |
分子中所有碳原子不可能共平面的是( )
| A、丁烷 | B、乙烯 | C、苯 | D、甲苯 |
关于可逆反应:aA(g)+bB(g)?cC(g)+dD(g)△H的有关图象如下:则下列不正确的是( )
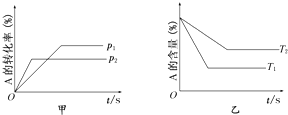

| A、p1<p2 T1>T2 |
| B、减小压强,正逆反应速率都减小,平衡右移 |
| C、△H>0△S>0 |
| D、升高温度,混合气体的平均摩尔质量增大 |
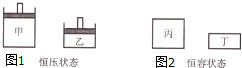 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g),其正反应放热.图1、图2表示起始时容器甲、丙体积都V,容器乙、丁体积都是| V |
| 2 |
| A、图1达平衡时,浓度c(SO2):甲=乙 |
| B、图1达平衡时,平衡常数K:甲>乙 |
| C、图2达平衡时,所需时间t:丙<丁 |
| D、图2达平衡时,体积分数φ(SO3):丙>丁 |
CS2是一种有恶臭的液体,它滴入用H2SO4酸化的KMnO4溶液时,有黄色沉淀析出,并放出CO2气体.当产生0.5mol CO2时,转移的电子数目是( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
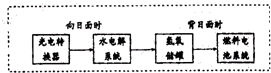 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.