��Ŀ����
 �����ߡ������־���ҹ��ĺ�����ҵ�������µ�ƪ�£�
�����ߡ������־���ҹ��ĺ�����ҵ�������µ�ƪ�£���1���������ʱ�������������ľ���Ħ�����������£�Ϊ�˷�ֹ����¶ȹ��ߣ��ڻ��һ��Ϳ��һ�������Ϳ�ϣ���Ϳ�ϵ���������ܵ���
A���ڸ����²��ڻ�B���ڸ����¿ɷֽ�����C���ڳ����¾ͷֽ�����D����Ϳ�ϲ����ܷ����ֽ�
��2�����������Ҫ���ܵ�ȼ�ϣ���������N2O4��N2H4����Ϊȼ�ϣ��䷴Ӧ�ķ���ʽ�ǣ�N2O4+N2H4��N2+H2O������ƽ�÷�Ӧ����ʽ��
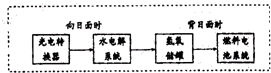
��3����ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOHΪ���Һ��ȼ�ϵ�طŵ�ʱ�ĸ�����ӦΪ��
��4�������˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϣ���֪�÷�Ӧ��������ӦΪ��4OH-4e-=O2��+2H2O��������ӦΪ��
��5���������˻ᡰ���ơ����ȼ���DZ��飨C3H8��������������˻���ȼ���DZ�ϩ��C3H6����
�ٱ�������ɵñ�ϩ��
��֪��C3H8��g���TCH4��g��+HC��CH��g��+H2��g������H1=156.6kJ?mol-1
CH3CH=CH2��g���TCH4��g��+HC=CH��g������H2=32.4kJ?mol-1
����ͬ�����£���ӦC3H8��g���TCH3CH=CH2��g��+H2��g���ġ�H=
���㣺ԭ��غ͵��صĹ���ԭ��,������ԭ��Ӧ����ʽ����ƽ,�Ȼ�ѧ����ʽ
ר�⣺�����������������
��������1��Ϊ�˷�ֹ����¶ȹ��ߣ��ڻ������Ϳ��һ�������Ϳ����Ϊ�˸�������µģ����Ը�Ϳ���ڸ�����Ӧ���ܹ�������
��2�����ݵ�ʧ�����غ㣬���ԭ���غ���ƽ����Nԭ�ӵĹ��з�Ӧ�е����غ��𣻷�Ӧ����Ϊ������ˮ������Ⱦ��
��3�������ڸ�������������Ӧ��ע����Ի�����ij��ʱ�������������й��ռ���33.6L��Ϊ1.5mol���壬����������1mol��ת�Ƶ���2mol���ݴ˼��㣻
��4������������ԭ��Ӧ��CO2����ԭ����CO�����ݼ���˹�����ܵĴ�С�жϷ�Ӧ�ܷ���У�
��5�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��2�����ݵ�ʧ�����غ㣬���ԭ���غ���ƽ����Nԭ�ӵĹ��з�Ӧ�е����غ��𣻷�Ӧ����Ϊ������ˮ������Ⱦ��
��3�������ڸ�������������Ӧ��ע����Ի�����ij��ʱ�������������й��ռ���33.6L��Ϊ1.5mol���壬����������1mol��ת�Ƶ���2mol���ݴ˼��㣻
��4������������ԭ��Ӧ��CO2����ԭ����CO�����ݼ���˹�����ܵĴ�С�жϷ�Ӧ�ܷ���У�
��5�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
���
�⣺��1��Ϊ�˷�ֹ����¶ȹ��ߣ��ڻ������Ϳ��һ�������Ϳ�ϣ���Ϳ�ϵ��������п������ڸ����¿ɷֽ���������Ϊ��������ʱ�ܹ������������Ӷ�ʹ������¶Ƚ��ͣ�ֻ��B���ϣ��ʴ�Ϊ��B��
��2��N2O4��N2H4��Ӧ����N2��N2O4��NԪ�صĻ��ϼ۴�+4�۽��͵�0��ת��4�����ӣ�����1������ת��8�����ӣ�N2H4��NԪ�صĻ��ϼ۴�-2�����ߵ�0��ת��2�����ӣ�����1������ת��4�����ӣ����ݵ�ʧ�����غ���ƽ��������N2O4Ϊ1��N2H4Ϊ2���ٸ���ԭ���غ�ƽ�ⷽ��ʽΪ��N2O4+2N2H4=3N2+4H2O����Ӧ��Nԭ�ӵĹ��з�Ӧ��2mol+4�۵�N��4mol-2�۵�N��Ӧ������0�۵�N���ʣ���������ԭ���뱻��ԭ��ԭ�ӵ����ʵ���֮��Ϊ2��1����Ӧ����Ϊ������ˮ������Ⱦ�������ڴ�������������
�ʴ�Ϊ��1��2��3��4��2��1����Ӧ��������Ⱦ�������ڴ�������������
��3�������ڸ�������������Ӧ���ڼ��Ի����н����������������ˮ���缫��ӦʽΪH2-2e-+2OH-=2H2O�����ij��ʱ�������������й��ռ���33.6L��Ϊ1.5mol���壬��ⷽ��ʽΪ2H2O
2H2��+O2����������1mol������0.5mol����������1mol����ת�Ƶ���2mol�����Ըö�ʱ����ˮ���ϵͳ��ת�Ƶ��ӵ����ʵ���Ϊ2mol��
�ʴ�Ϊ��H2-2e-+2OH-=2H2O��2��
��4������������ԭ��Ӧ��CO2����ԭ����CO��������ӦΪ��2CO2+4e-+2H2O=2 CO+4OH-��
��Ӧ2CO=2C+O2����H��0����S��0�������G=��H-T?��S��0����Ӧ��һ���������ؼ��ķ�Ӧ���κ�����²����Է����У�
�ʴ�Ϊ��2CO2+4e-+2H2O=2 CO+4OH-�������У��÷�Ӧ��һ���������ؼ��ķ�Ӧ���κ�����²����Է����У�
��5����C3H8��g����CH4��g��+HC��CH��g��+H2��g����H1=156.6kJ?mol-1
��CH3CH=CH2��g����CH4��g��+HC��CH��g����H2=32.4kJ?mol-1
���ݸ�˹���ɢ�-�ڵõ�C3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol
����ͬ�����£���ӦC3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol��
�ʴ�Ϊ��124.2��
��2��N2O4��N2H4��Ӧ����N2��N2O4��NԪ�صĻ��ϼ۴�+4�۽��͵�0��ת��4�����ӣ�����1������ת��8�����ӣ�N2H4��NԪ�صĻ��ϼ۴�-2�����ߵ�0��ת��2�����ӣ�����1������ת��4�����ӣ����ݵ�ʧ�����غ���ƽ��������N2O4Ϊ1��N2H4Ϊ2���ٸ���ԭ���غ�ƽ�ⷽ��ʽΪ��N2O4+2N2H4=3N2+4H2O����Ӧ��Nԭ�ӵĹ��з�Ӧ��2mol+4�۵�N��4mol-2�۵�N��Ӧ������0�۵�N���ʣ���������ԭ���뱻��ԭ��ԭ�ӵ����ʵ���֮��Ϊ2��1����Ӧ����Ϊ������ˮ������Ⱦ�������ڴ�������������
�ʴ�Ϊ��1��2��3��4��2��1����Ӧ��������Ⱦ�������ڴ�������������
��3�������ڸ�������������Ӧ���ڼ��Ի����н����������������ˮ���缫��ӦʽΪH2-2e-+2OH-=2H2O�����ij��ʱ�������������й��ռ���33.6L��Ϊ1.5mol���壬��ⷽ��ʽΪ2H2O
| ||
�ʴ�Ϊ��H2-2e-+2OH-=2H2O��2��
��4������������ԭ��Ӧ��CO2����ԭ����CO��������ӦΪ��2CO2+4e-+2H2O=2 CO+4OH-��
��Ӧ2CO=2C+O2����H��0����S��0�������G=��H-T?��S��0����Ӧ��һ���������ؼ��ķ�Ӧ���κ�����²����Է����У�
�ʴ�Ϊ��2CO2+4e-+2H2O=2 CO+4OH-�������У��÷�Ӧ��һ���������ؼ��ķ�Ӧ���κ�����²����Է����У�
��5����C3H8��g����CH4��g��+HC��CH��g��+H2��g����H1=156.6kJ?mol-1
��CH3CH=CH2��g����CH4��g��+HC��CH��g����H2=32.4kJ?mol-1
���ݸ�˹���ɢ�-�ڵõ�C3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol
����ͬ�����£���ӦC3H8��g����CH3CH=CH2��g��+H2��g����H=+124.2KJ/mol��
�ʴ�Ϊ��124.2��
���������⿼���˷�Χ�㣬��Ŀ�Ѷȴ�ע��������ԭ��Ӧ�еĵ����غ㡢�缫��Ӧʽ��д����˹���ɵ�Ӧ�ã�

��ϰ��ϵ�д�
 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
�����Ŀ
����ʵ�������ȷ���ǣ�������
A�� ��ȥCl2�е�HCl���� |
B�� ������ˮ |
C�� ϡ��Ũ���� |
D�� ������ȡ���� |
��������������غ������Ļ����Һ�У����c��SO42-=0.2mol/L�����ӵ������0.2mol/L��KOH��Һʱ�����ɵij���ǡ���ܽ⣬��ԭ�������K+��Ũ���ǣ�������
| A��0.2 mol/L |
| B��0.25 mol/L |
| C��0.45 mol/L |
| D��0.225 mol/L |