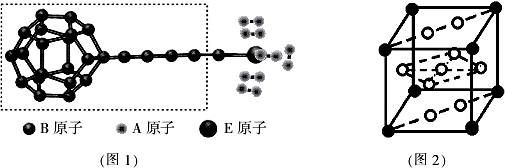
题目内容
2.(1)催化剂能改变化学反应的速率,原因是改变化学反应的路径.某同学在实验中发现,向2mL5%H2O2溶液中分别滴入FeCl3和FeCl2溶液,都立即产生大量气泡;向反应后的溶液中滴入几滴KSCN溶液,溶液均变为红色.查阅资料知:FeCl3在H2O2分解中发生如下反应:①2Fe3++H2O2═2Fe2++2H++O2↑ ②2Fe2++2H++H2O2═2Fe3++2H2O
在反应①中Fe3+作氧化剂;在反应②中Fe3+是氧化产物.有同学认为Fe2+也可作H2O2分解的催化剂,你认为该观点是否正确,并简述理由正确
Fe2+先被H2O2氧化:2Fe2++2H++H2O2═2Fe3++2H2O,再发生反应:2Fe3++H2O2═2Fe2++2H++O2↑,总反应为:2H2O2$\frac{\underline{\;二价铁离子\;}}{\;}$2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂.
(2)反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,加入少许MnSO4固体能明显观察到溶液紫色褪去时间变短.在试管中加入4mL0.01mol/LKMnO4酸性溶液和2mL0.1mol/LH2C2O4溶液,实验初始阶段时间-速率图象合理的是图1中的B(填序号).
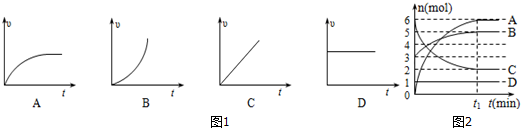
(3)某反应体系中存在A、B、C、D四种物质,反应过程中各物质的物质的量变化如图2所示,请写出该反应的化学方程式2C?3A+B.
(4)焙烧明矾产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)═2SO3(g)△H1=-197kJ•mol-1;
H2O(g)═H2O(l)△H2=-44kJ•mol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1.
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
分析 (1)化合价降低,得到电子做氧化剂,化合价升高被氧化得到氧化产物,根据反应①②可知Fe2+也可作H2O2分解的催化剂;
(2)加入少许MnSO4固体能明显观察到溶液紫色褪去时间变,说明Mn2+对该反应有催化作用,则实验开始反应速率慢,当生成的Mn2+越来越多,反应速率加快;
(3)反应物物质的量减少,生成物物质的量增加,最终各物质的量不再变化,该反应是可逆反应,则C是反应物,A、B是生成物,D一直没变,没有参加反应,根据相同时间A、B、C变化量之比等于计量数之比确定方程式;
(4)利用盖斯定律,将热化学方程式进行运算,(③-①-②×2)×$\frac{1}{2}$计算反应的焓变,得到SO3(g)与H2O(l)反应的热化学方程式.
解答 解:(1)Fe3+化合价降低,得到电子做氧化剂,Fe2+化合价升高被氧化得到Fe3+,Fe3+是氧化产物;Fe2+先被H2O2氧化:2Fe2++2H++H2O2═2Fe3++2H2O,再发生反应:2Fe3++H2O2═2Fe2++2H++O2↑,总反应为:2H2O2$\frac{\underline{\;二价铁离子\;}}{\;}$2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂,
故答案为:氧化剂;氧化产物;正确;Fe2+先被H2O2氧化:2Fe2++2H++H2O2═2Fe3++2H2O,再发生反应:2Fe3++H2O2═2Fe2++2H++O2↑,总反应为:2H2O2$\frac{\underline{\;二价铁离子\;}}{\;}$2H2O+O2↑,在反应前后Fe2+性质和质量不变,Fe2+作H2O2分解的催化剂;
(2)加入少许MnSO4固体能明显观察到溶液紫色褪去时间变,说明Mn2+对该反应有催化作用,则实验开始反应速率慢,当生成的Mn2+越来越多,反应速率加快,只有B符合先慢后快,
故答案为:B;
(3)反应物物质的量减少,生成物物质的量增加,最终各物质的量不再变化,该反应是可逆反应,则C是反应物,A、B是生成物,D一直没变,没有参加反应,根据相同时间A、B、C变化量之比为4:6:2,则各物质计量数之比为2:3:1,方程式为2C?3A+B,
故答案为:2C?3A+B;
(4)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
H2O (g)=H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②×2)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
点评 本题探究催化剂在双氧水分解中的作用以及催化剂对反应速率的影响,要求学生灵活运用信息解答,方程式的确定中对D的处理比较新颖,盖斯定律属于常规题目.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 铜锌原电池中铜是负极 | |
| B. | 用电解法精炼粗铜时,纯铜作阳极 | |
| C. | 在镀件上电镀铜时可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
| A. | 18.75% | B. | 30% | C. | 15% | D. | 22.5% |
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeO和Fe2O3 |
| A. | 常温下,在某弱酸HA溶液中加入NaA固体后,$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 常温下,0.1 mol•L-1的NH4HCO3溶液其pH=7.8,则Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | 已知常温低下Ksp(AgI)=2.0×10-16,在AgI悬浊液中加入少量KI粉末,AgI(s)?Ag+(aq)+I-(aq)平衡向左移动,溶液中离子的总浓度会减小 |
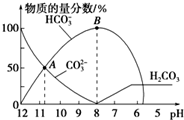 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
| A. | 该 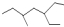 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 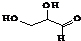 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |