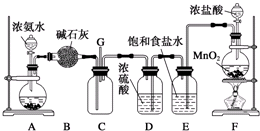
题目内容
9.下列关于铜电极的叙述中,正确的是( )| A. | 铜锌原电池中铜是负极 | |
| B. | 用电解法精炼粗铜时,纯铜作阳极 | |
| C. | 在镀件上电镀铜时可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
分析 A.锌的活泼性大于铜,则锌为负极,铜为正极;
B.电解精炼铜时,阳极发生氧化反应,则阳极为粗铜;
C.电镀时,镀件为阴极,镀层金属为阳极;
D.若铜为阳极,阳极铜失去电子生成铜离子,则阳极不会生成氧气.
解答 解:A.铜锌原电池中,活泼性较强的为负极,则Zn为负极、Cu为正极,故A错误;
B.用电解法精炼粗铜时,阳极发生氧化反应、阴极发生还原反应,则纯铜作阴极,粗铜为阳极,故B错误;
C.在镀件上电镀铜时,镀件为阴极,阳极为镀层金属,所以可用金属铜作阳极,故C正确;
D.电解稀硫酸制H2、O2时,若铜作阳极,则阳极铜放电,阳极生成的为铜离子,不会生成氧气,所以阳极应该为惰性电极,故D错误;
故选C.
点评 本题考查了原电池、电解池工作原理,题目难度不大,涉及电镀、粗铜冶炼等知识,明确原电池、电解池工作原理为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
13.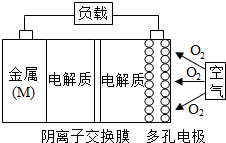 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
金属(M)-空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n,已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )| A. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 | |
| B. | 比较Mg,Al,Zn三种金属-空气电池,Al-空气电池的理论比能量最高 | |
| C. | M-空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne-=4M(OH)n | |
| D. | 在Mg-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 |
20.下列叙述正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
17.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
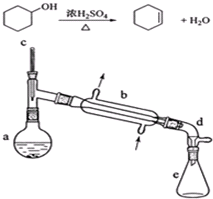
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为 .
.

可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为
 .
.
14.下列离子方程式中,正确的是( )
| A. | 盐酸与氨水混合:H++OH-═H2O | |
| B. | 金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸钠与过量稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 氯气与碘化钾溶液的反应:Cl2+I-=I2+Cl- |
18.将两个铂电极用导线连接,放置在NaOH溶液中,然后向两极分别通入甲烷和氧气,下列叙述正确的是( )
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |