题目内容
12.已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同.F是第四周期d区原子序数最大的元素.请回答下列问题:(1)写出E的价层电子排布式3d24s2.
(2)A、B、C、D电负性由大到小的顺序为O>N>C>H(填元素符号).
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、
苯等有机溶剂,呈四面体构型,该晶体的类型为分子晶体,F与BD之间的作用力为配位键.
(4)开发新型储氢材料是氢能利用的重要研究方向.
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有3种;
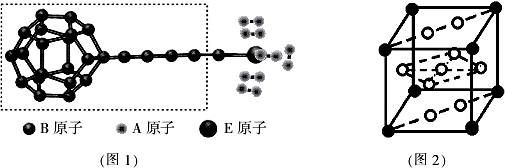
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号);
A.H2O B.CH4 C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为LaNi5;已知其摩尔质量为M g•mol-1,晶胞参数为apm,用NA表示阿伏伽德罗常数,则该晶胞的密度为$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$g•cm-3.
分析 A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,据此解答.
解答 解:A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.
A的质子数、电子层数、最外层电子数均相等,则A为H元素;
B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,电子排布为1s22s22p2,则B为C元素;
D的基态原子核外成对电子数是成单电子数的3倍,则D为O元素,故C为N元素;
E4+与氩原子的核外电子排布相同,则E为Ti元素;
F是第四周期d区原子序数最大的元素,则F为Ni元素,
(1)E为22号元素Ti,其价层电子排布式为3d24s2,
故答案为:3d24s2;
(2)同周期元素从左到右电负性逐渐增大,电负性由大到小的顺序为O>N>C>H,
故答案为:O>N>C>H;
(3)Ni(CO)4熔沸点较低,为分子晶体;Ni为过渡元素容易提供空轨道,而CO提供孤对电子,二者形成配位键,
故答案为:分子晶体;配位键;
(4)①图中虚线框内碳原子之间的化学键有C-C、C=C、C≡C,其杂化类型分别为sp3杂化、sp2杂化、sp杂化,所以杂化轨道类型有3种,
故答案为:3;
②CH4分子间没有氢键不能形成“笼状结构”,每个HF只能形成2个氢键,所以HF分子间只能形成链状结构,
故答案为:BC;
③该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×$\frac{1}{2}$=5,晶胞实际含有的镧原子为8×$\frac{1}{8}$=1,所以晶体的化学式LaNi5,晶胞的密度ρ=$\frac{m}{V}$=$\frac{M}{{N}_{A}×(a×1{0}^{-10}cm)^{3}}$=$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$,
故答案为:LaNi5;$\frac{M}{{N}_{A}•{a}^{3}}×1{0}^{30}$.
点评 题目综合性较大,涉及电负性、晶体、化学键、杂化轨道、晶胞计算等,难度中等,注意运用杂化理论推导分子构型.

(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
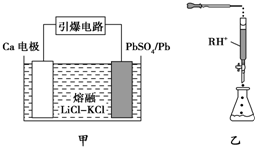
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.
(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.
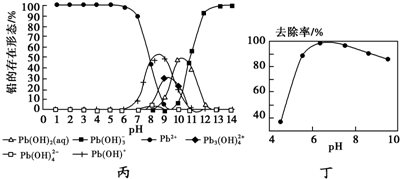
①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
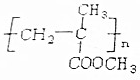 ,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )| A. | 丁酸 | B. | CH2=CHCH2COOH | C. | 甲酸丙酯 | D. | 丙烯酸甲酯 |
 .
.