题目内容
14.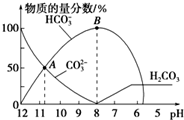 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
分析 A.任何电解质溶液中都存在电荷守恒,阴阳离子所带电荷总数相同;
B.根据电荷守恒判断各离子浓度大小;
C.根据图象,溶液pH=7时,存在氯离子、碳酸氢根跟离子、碳酸电离产生的少量碳酸根离子;
D.HCO3-电离平衡常数Ka=$\frac{c(C{{O}_{3}}^{2-})c({H}^{+})}{c(HC{{O}_{3}}^{-})}$=5×10-11,pH=10,c(H+)=10-10mol/L,c(HCO3-):c(CO32-)=2:1.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),故A错误;
B.B点溶液呈碱性,溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于氢离子浓度较小,则离子浓度最大的为钠离子,故B错误;
C.根据图象,溶液pH=7时,存在氯离子、碳酸氢根跟离子、碳酸电离产生的少量碳酸根离子,故C错误;
D.HCO3-电离平衡常数Ka=$\frac{c(C{{O}_{3}}^{2-})c({H}^{+})}{c(HC{{O}_{3}}^{-})}$=5×10-11,pH=10,c(H+)=10-10mol/L,c(HCO3-):c(CO32-)=2:1,故D正确.
故选D.
点评 本题考查了离子浓度大小的比较,题目难度中等,明确反应后溶质组成为解答关键,注意根据物料守恒、电荷守恒进行分析解答,试题侧重考查学生的分析、理解能力.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
2.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |
9.我国新修订的《环境保护法》已于2015年1月1日起施行.下列有关做法不正确的是( )
| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
19.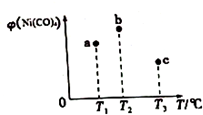 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
6.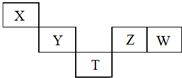 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |