题目内容
11.下列说法正确的是( )| A. | 该 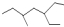 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 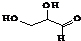 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
分析 A.支链编号错误,应从离甲基较近的一端开始编号;
B.油脂不是高分子化合物;
C. 为多羟基醛,含有羟基、醛基;
为多羟基醛,含有羟基、醛基;
D.乙烯分子式为C2H4,乙醇的分子式为C2H6O2,等物质的量时消耗的氧气的量相同,二者摩尔质量不同,则等质量时消耗的氧气的量不同.
解答 解:A. 有机物的系统命名为:3-甲基-5-乙基庚烷,故A错误;
有机物的系统命名为:3-甲基-5-乙基庚烷,故A错误;
B.高分子化合物的相对分子质量在10000以上,油脂不是高分子化合物,故B错误;
C. 为多羟基醛,含有羟基、醛基,属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应,故C正确;
为多羟基醛,含有羟基、醛基,属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应,故C正确;
D.乙烯分子式为C2H4,乙醇的分子式为C2H6O2,等物质的量时消耗的氧气的量相同,二者摩尔质量不同,则等质量时消耗的氧气的量不同,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的组成、结构和性质,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
18.将两个铂电极用导线连接,放置在NaOH溶液中,然后向两极分别通入甲烷和氧气,下列叙述正确的是( )
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |
19.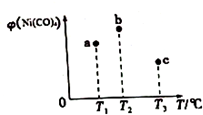 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
6.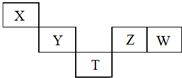 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
16.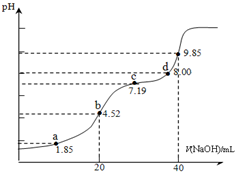 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)>3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
20.铅及其化合物在生产及生活中都具有非常广泛的用途.
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
①该还原反应的△H<0(填“>”、“<”或“=”).
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
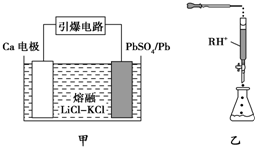
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.
(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.
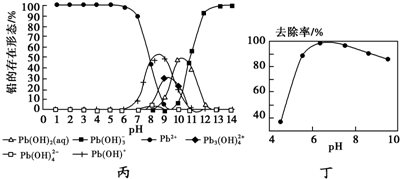
①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.

(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.

①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
1.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |